题目内容
氢镍电池是一种碱性可充电电池,污染小,比能量较大。氢镍电池的总反应式是:
H2+2NiO(OH) 2Ni(OH)2。据此反应式判断,下列叙述中正确的是
2Ni(OH)2。据此反应式判断,下列叙述中正确的是
| A.电池放电时,H2是正极 |
| B.电池充电时,镍元素被还原 |
| C.充电时,电池负极的电极反应式为2H2O+2e—=H2+2OH— |
| D.电池放电时,H2是负极,负极周围溶液的pH不断增大 |
C
解析试题分析:A、放电时是原电池,H2作负极失电子化合价升高,错误;B、根据镍的化合价判断,充电时,镍由+2价变成+3价,化合价升高,被氧化,错误;C、充电时,电池负极(即电解池的阴极)的电极反应式为2H2O+2e—=H2+2OH—,正确;D、放电时电池负极反应为H2 -2e-+2OH-=2H2O,电池负极周围溶液的OH- 浓度不断减小,pH不断减小,错误。
考点:新型原电池。

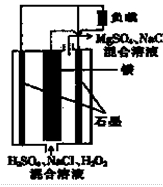
有关如右图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,不正确的是
| A.铜片上有红色物质附着 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.反应中,盐桥中的K+会移向CuSO4溶液 |
| D.锌片上发生氧化反应 |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe。有关该电池的下列叙述中,正确的是( )
| A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为2Li+FeS=Li2S+Fe |
| C.负极的电极反应式为Al-3e-=Al3+ |
| D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-=2Li++FeS |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为,3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 |
C.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO + 4H2O + 4H2O |
| D.放电时正极附近溶液的碱性增强 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为
2CH3OH + 3O2 + 4OH-  2CO32- + 6H2O, 则下列说法中正确的是
2CO32- + 6H2O, 则下列说法中正确的是
| A.充电时有CH3OH生成的电极为阳极 |
| B.充电时每生成1 mol CH3OH转移12mol电子 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32-+ 6H2O |
关于下列各装置图的叙述中,不正确的是( )
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液。下列说法中不正确的是( )
| A.K+移向催化剂b |
B.催化剂a表面发生的化学反应:Fe(CN -e- -e- Fe(CN Fe(CN |
C.Fe(CN 在催化剂b表面被氧化 在催化剂b表面被氧化 |
D.电解质溶液中的Fe(CN 和Fe(CN 和Fe(CN 浓度基本保持不变 浓度基本保持不变 |
如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。下列说法中,正确的是
| A.燃料电池工作时,正极反应为:O2 + 4H++ 4e-= 2H2O |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是含锌、铁的粗铜,b极是纯铜, a极溶解铜的质量与b极析出铜的质量相等 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |