题目内容
20.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )| A. | 酯化反应的产物只有酯 | |
| B. | 酯化反应一般需要用NaOH溶液来吸收生成的酯 | |
| C. | 酯化反应是有限度的 | |
| D. | 浓硫酸可做酯化反应的催化剂 |
分析 酯化反应是醇跟羧酸或无机含氧酸生成酯和水的反应,分为羧酸跟醇反应和无机含氧酸跟醇反应两类,反应中酸提供-OH,醇提供-OH上的H,由于酯类在饱和碳酸钠中溶解度较小,一般用饱和碳酸钠来提纯乙酸乙酯.
解答 解:A、酯化反应除生成酯还生成水等,故A错误;
B、用饱和碳酸钠溶液吸收乙酸乙酯,氢氧化钠会促进酯的水解,故B错误;
C、酯化反应是典型的可逆反应,反应是有限度的,故C正确;
D、酯化反应中浓硫酸做催化剂,还作吸水剂,故D正确.
故选:AB.
点评 本题考查酯化反应,难度较小,旨在考查学生对基础知识的掌握,注意酯化反应的本质醇脱羟基上的氢原子,酸脱羟基.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
9.如图图示与对应的叙述相符的是( )


| A. | 由图甲表示的反应速率随温度变化的关系可知该反应的△H>0 | |
| B. | 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)═N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| C. | 图丙表示该反应为放热反应,且催化剂能改变反应的焓变 | |
| D. | 绝热恒容密闭容器中发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g),其正反应速率随时间变化如图丁所示,则c点一定是平衡点 |
11.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol Cl2与足量的Fe充分反应,转移电子的数目为3NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| C. | 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol ${\;}_{6}^{14}$C原子中所含中子数目为6NA |
8.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 短周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
15.下列实验能达到预期目的是( )
| A. |  用于判断SO2能否与钡盐反应 | B. |  用于判断硼酸、碳酸的酸性强弱 | ||
| C. | 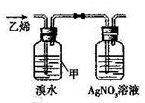 用于判断甲中发生的是加成反应 | D. | 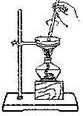 用于AlCl3的蒸发结晶 |
5.下列实验装置设计正确,且能达到实验目的是( )

| A. | 实验Ⅰ:制备金属钠 | B. | 实验Ⅱ:制取Fe(OH)2并观察其颜色 | ||
| C. | 实验Ⅲ:制取NaAlO2 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
12.下列鉴别方法不可行的是( )
| A. | 仅用氨水即可鉴别NaCl、AlBr3、FeI2、AgNO3四种溶液 | |
| B. | 用燃烧法鉴别环己醇、苯和四氯化碳 | |
| C. | 用烧碱溶液鉴别地沟油、甘油和石油 | |
| D. | 用新制氯水鉴别碘的淀粉溶液、含石蕊的烧碱溶液、硫酸铜溶液等三种蓝色溶液 |
9.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
| A. | NH4Cl→NH3↑+HCl↑ | B. | NH3+CO2+H2O→NH4HCO3 | ||
| C. | 2NaOH+Cl2→NaCl+NaClO+H2O | D. | 2Na2O2+2CO2→2Na2CO3+O2 |
10.一种具有除草功效的有机物的结构简式如图所示.下列有关该化合物的说法正确的是( ) 

| A. | 分子中含有2个手性碳原子 | |
| B. | 能发生氧化、取代、加成反应 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |