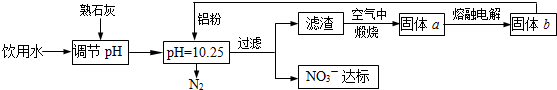
题目内容
饮用水中的N| O | - 3 |
| O | - 3 |
a.在微碱性条件下,用Fe(OH)2还原N
| O | - 3 |
b.在碱性条件下,用铝粉还原N
| O | - 3 |
(1)方案a中,生成l7gNH3的同时生成
(2)方案b中发生的反应如下(配平该反应方程式并回答下列问题):
| O | - 3 |
| O | - 2 |
该反应中
(3)方案b中,当有0.3mol电子转移时,生成的氮气在标准状况下的体积为
分析:(1)根据n=
计算17gNH3的物质的量,反应中Fe(OH)2→Fe(OH)3,NO3-→NH3,根据电子转移计算生成Fe(OH)3的物质的量;
(2)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,结合电荷守恒、原子守恒配平其它物质的系数;
反应中N元素化合价降低,被还原;
根据化合价变化,计算注意电子数目;
(3)根据电子转移守恒计算生成氮气的物质的量,再根据V=nVm计算氮气的体积.
| m |
| M |
(2)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,结合电荷守恒、原子守恒配平其它物质的系数;
反应中N元素化合价降低,被还原;
根据化合价变化,计算注意电子数目;
(3)根据电子转移守恒计算生成氮气的物质的量,再根据V=nVm计算氮气的体积.
解答:解:(1)17gNH3的物质的量为
,反应中Fe(OH)2→Fe(OH)3,NO3-→NH3,根据电子转移可知,生成Fe(OH)3的物质的量为
=8mol,
故答案为:8;
(2)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知系数为,由H元素守恒可知系数为,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,反应中N元素化合价降低,被还原,
有10molAl参加反应,则转移的电子的物质的量为10mol×3=30mol,
故答案为:10;6;4;10;3;2;N;还原;30mol;
(3)根据电子转移守恒,有0.3mol电子转移时生成氮气的物质的量为
=0.03mol,氮气的体积为0.03mol×22.4L/mol=0.672L=672mL,故答案为:672.
| 17g |
| 17g/mol |
| 1mol×[5-(-3)] |
| 3-2 |
故答案为:8;
(2)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知系数为,由H元素守恒可知系数为,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,反应中N元素化合价降低,被还原,
有10molAl参加反应,则转移的电子的物质的量为10mol×3=30mol,
故答案为:10;6;4;10;3;2;N;还原;30mol;
(3)根据电子转移守恒,有0.3mol电子转移时生成氮气的物质的量为
| 0.3mol |
| 2×5 |
点评:本题考查氧化还原反应的配平、计算、基本概念等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目