题目内容
10.下列表示对应化学反应的离子方程式,其中正确的是( )| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NaHSO4溶液中加入Ba(OH)2溶液至SO42完全沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | (NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
分析 A.二者反应生成苯酚与碳酸氢钠;
B.NaHSO4溶液中加入Ba(OH)2溶液至SO42完全沉淀,反应生成硫酸钡、氢氧化钠和水;
C.(NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液反应生成硫酸钡、氢氧化亚铁和一水合氨;
D.氢氧化镁为沉淀,应保留化学式.
解答 解:A.苯酚钠溶液中通入少量CO2,离子方程式:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故A错误;
B.NaHSO4溶液中加入Ba(OH)2溶液至SO42完全沉淀,离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故B正确;
C.(NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液,离子方程式为2NH4++Fe2++SO42-+Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2NH3↑+2H2O,故C错误;
D.用惰性电极电解饱和氯化镁溶液:2Cl-+Mg2++2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确电解原理、明确化学式的拆分原则是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
1.25℃时,将pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合后溶液pH=a,以下关于所得溶液的关系式肯定错误的是( )
| A. | a>7 | B. | c(CH3COOH)-c(OH-)>10-amol/L | ||
| C. | c(Na+)=c(CH3COOH)+c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
18.在下列影响化学反应速率因素中,肯定能使化学反应速率加快的方法是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末.
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末.
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有③④ | D. | ①②③④ |
15.对如表实验现象或操作解释错误的是( )
| 现象或操作 | 解 释 | |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 配制SnCl2溶液时,先将SnCl2溶于适量稀盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
2.下列各组有机物中,只需加入溴水就能一 一鉴别的是( )
| A. | 甲苯、苯、己烯 | B. | 己炔、己烯、四氯化碳 | ||
| C. | 己烯、苯、乙醇 | D. | 己烯、苯、煤油 |
3.已知浓硫酸与木炭粉在加热条件下的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑十CO2↑2H2O↑.酸性KMnO4溶液可以吸收SO2,试用如图所示各装置设计一个实验,验证上述反应所产生的各种产物.
(1)这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):④→②→①→③.
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是验证产物的SO2,B瓶溶液的作用是将SO2全部氧化吸收,C瓶溶液的作用是确定产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水硫酸铜,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间.
(4)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2.
| 编号 | ① | ② | ③ | ④ |
| 装置 | 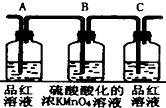 | 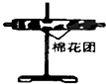 |  | 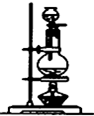 |
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是验证产物的SO2,B瓶溶液的作用是将SO2全部氧化吸收,C瓶溶液的作用是确定产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水硫酸铜,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间.
(4)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2.
4.在标准状况下,有一氧化碳和二氧化碳的混合气体5.6L.如果一氧化碳的质量为5.6g,则二氧化碳的质量为( )
| A. | 4.4g | B. | 3.3g | C. | 1.1g | D. | 2.2g |