题目内容
5.二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:①CO(g)+2H2(g)?CH3OH(g)△H1=-Q1 kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-Q2 kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-Q3 kJ•mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的热化学方程式为3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3)kJ/mol.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH (g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(Κ).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
A.体系的压强不变
B.密度不变
C.混合气体的相对分子质量不变
D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2 充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.04.
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H=-92.4kJ•mol-1.实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图1.请回答下列问题:
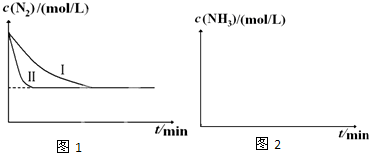
①与实验Ⅰ比较,实验Ⅱ改变的条件为加入催化剂.
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图2中画出实验Ⅰ和实验Ⅲ中c(NH3)随时间变化的示意图.
分析 (1)反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)可以看作题中①×2+②+③得到,根据盖斯定律可写出热化学方程式;
(2)①根据温度对平衡常数的影响判断反应的热效应,根据平衡状态的特征判断平衡状态;
②根据平衡常数等于生成浓度系数次幂之积除以反应浓度系数次幂之积,结合反应中各物质平衡浓度可计算平衡常数;
(3)①根据图象可知,实验Ⅱ与实验Ⅰ相比,反应达到平衡的时间变短,平衡不移动,据此判断;
②合成氨反应为放热反应,升高温度平衡逆向移动,平衡时氨气浓度减小,但反应速率变快,所以达到平衡的时间变短,据此可画出图象.
解答 解:(1)根据盖斯定律,①×2+②+③,整理可得:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3) kJ/mol,
故答案为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-(2Q1+Q2+Q3)kJ/mol;
(2)①升高温度,化学平衡常数减小,说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,所以△H<0;
A.由于该反应是反应前后气体体积不等的反应,若未达到平衡,则体系的压强就会发生改变,所以体系的压强不变,则反应达到平衡状态,正确;
B.密度不变由于反应混合物都是气体,所以在任何时刻物质的密度都不发生变化,因此不能作为判断平衡的标志,错误;
C.由于该反应是反应前后气体体积不等的反应,若未达到平衡,则体系的气体的物质的量就会发生变化,气体的相对分子质量就会改变,若气体的相对分子质量不变,则反应达到平衡状态,正确;
D.c(CO)=c(CH3OH)时反映可能处于平衡状态,也可能未达到平衡,因此不能作为判断平衡的标志,错误;
故答案为:<; A、C;
②某温度下,在反应开始是c(CO)=1.0mol/L,c(H2)=3.0mol/L,将 2mol CO和 6mol H2,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,则平衡时c(H2)=1.4mol/L,c(CH3OH)=0.8mol/L,则此温度下的平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•c{\;}^{2}({H}_{2})}$=$\frac{0.8}{0.2×1.{4}^{2}}$=2.04,
故答案为:2.04;
(3)①根据图象可知:与实验Ⅰ比较,实验Ⅱ反应速率大大加快,达到平衡所需要的时间缩短,但是N2平衡浓度没有改变,因此平衡未发生移动,则改变的条件为加入催化剂,
故答案为:加入催化剂;
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,由于升高温度化学反应速率加快,达到平衡所需要的时间缩短,但是由于该反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,因此达到平衡时NH3的含量降低,用图象表示实验I和实验Ⅲ中NH3浓度随时间变化的示意图是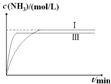 ,
,
故答案为: .
.
点评 本题主要考查热化学方程式的书写、反应热效应的判断、平衡状态的判断、催化剂、温度对平衡移动的影响的图象法表示、化学平衡常数的计算的知识,中等难度,答题时注意对平衡常数的理解和平衡移动原理的灵活运用.

| A. | 氯水中有下列平衡Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取降低温度的措施 |
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
| W | 灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色 |
元素Z的离子结构示意图为
 ,化合物WXY的电子式
,化合物WXY的电子式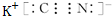 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| D. | 室温下,0.1 mol/L w的气态氢化物的水溶液的氢离子浓度小于0.1 mol/L |
| 现象或操作 | 解 释 | |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 配制SnCl2溶液时,先将SnCl2溶于适量稀盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
 金属铝、铁、铜及其化合物与生产、科研关系密切.
金属铝、铁、铜及其化合物与生产、科研关系密切.