题目内容
17.设NA为阿伏加德罗常数,下列说法中错误的是( )| A. | 常温常压下,22克CO2和0.5NA个CH4分子的体积是相等的 | |
| B. | 12克金属镁与足量的盐酸反应,转移电子数一定为NA | |
| C. | 7.8克Na2O2固体中所含阴离子数为0.2NA | |
| D. | 含1molFeCl3的分散系中,最多可形成胶体粒子数小于NA |
分析 A、在相同状态下,气体的体积之比等于物质的量之比;
B、求出镁的物质的量,然后根据反应后镁变为+2价来分析;
C、求出过氧化钠的物质的量,然后根据过氧化钠中含1个阴离子来分析;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、22g二氧化碳的物质的量为0.5mol,而0.5NA个甲烷分子的物质的量也为0.5mol,而在相同状态下,气体的体积之比等于物质的量之比,故两者的体积相同,故A正确;
B、12g镁的物质的量为0.5mol,而反应后镁变为+2价,故0.5mol镁失去1mol电子即NA个,故B正确;
C、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠中含1个阴离子,故0.1mol过氧化钠中含0.1mol阴离子即0.1NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁形成的胶粒的个数小于NA个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
8.下列有机物中,含有两种官能团的是( )
| A. | CH3-CH2-Cl | B. | CH3CHO | C. | CH2=CHBr | D. | CH3CH3-OH |
5.N2O俗称“笑气”,曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2═3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A. | 等物质的量的N2O和CO2含有相等的电子数 | |
| B. | N2O只有氧化性,无还原性 | |
| C. | 上述反应,每生成l mol N2O,消耗1.5 mol CO | |
| D. | N2O会迅速与人体血红蛋白结合,使人中毒 |
12.室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-=Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
2.用1L的1.0mol•L-1NaOH 溶液吸收0.7molCO2,所得溶液中的CO32-和HCO3-的浓度之比约是 ( )
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:4 |
6.下列说法不正确的是( )
| A. | 探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合 | |
| B. | 用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)分别为中和滴定实验和pH试纸 |
7.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工厂通常采用20 Mpa~50 MPa压强,以提高原料的利用率 | |
| C. | 打开啤酒瓶盖后有大量泡沫溢出 | |
| D. | 夏天将食品储藏在冰箱中 |





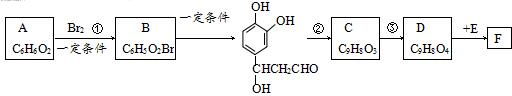
 ;D
;D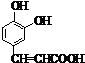 .
.
 +nH2O.
+nH2O.