��Ŀ����
����Ŀ����֪��I2��aq��+I����aq��I3����aq����ijI2��KI�����Һ�У�I3�������ʵ���Ũ��c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� �� 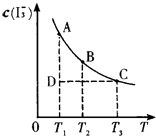
A.��ӦI2��aq��+I����aq��I3����aq���ġ�H��0
B.���¶�ΪT1��T2 �� ��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2 �� ��K1��K2
C.����Ӧ���е�״̬Dʱ��һ���Ц���������
D.״̬A��״̬B��ȣ�״̬A��c��I2����
���𰸡�C
���������⣺A�������¶ȵIJ������ߣ�I3����Ũ���ļ�С��˵����Ӧ���淽���ƶ�����I2��aq��+I����aq��I3����aq����һ�����ȷ�Ӧ������H��0����A���� B����Ϊ�¶�T2��T1 �� ���Ե��¶�����ʱ����Ӧ���淽���ƶ�����K1��K2 �� ��B����
C����ͼ�п��Կ���D�㲢û�дﵽƽ��״̬��������Ҫ��A���ƶ���I3����Ũ��Ӧ���ӣ�ƽ�����������ƶ�������v����v�� �� ��C��ȷ��
D���¶����ߣ�ƽ�����淽���ƶ���c��I3������С����c��I2��Ӧ�������״̬B��c��I2����D����
��ѡC��

����Ŀ��25��ʱijЩ����ĵ���ƽ�ⳣ�����±���ʾ��
CH3COOH | HClO | H2CO3 |
K��CH3COOH�� | K��HClO�� | K��H2CO3��a1=4.4��10��7 |
�����£�ϡ��CH3COOH��HClO������ʱ����Һ��pH���ˮ���仯��������ͼ��ʾ������˵����ȷ���ǣ� ��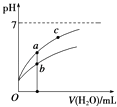
A.��ͬŨ�ȵ�CH3COOH��HClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��H+����c��ClO������c��CH3COO������c��OH����
B.ͼ����a��c������������Һ�� ![]() ��ȣ�HR����CH3COOH��HClO��
��ȣ�HR����CH3COOH��HClO��
C.ͼ����a�����Ũ�ȴ���b�����Ũ��
D.��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��2ClO��+CO2+H2O=2HClO+CO32��