题目内容
混合后c(OH-)=
| 10-6+10-4 |
| 2 |
| 10-4 |
| 2 |
则溶液中的c(H+)=
| Kw |
| c(OH-) |
| 1.0×10-14 | ||
|
故选C.

 应用题作业本系列答案
应用题作业本系列答案Ⅰ.实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu)∶m(O)=8∶a。当a有不同的取值时,固体混合物成分不同。请分析a的取值范围和固体混合物成分的关系并填入下表(不一定填满,表格不够也可自行增加)。
a的取值范围 | 反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
Ⅱ.黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:

(1)请通过计算确定m的值;
(2)X的摩尔质量为368 g·mol-1,请确定X的化学式_______________
Ⅰ.实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu)∶m(O)=8∶a。当a有不同的取值时,固体混合物成分不同。请分析a的取值范围和固体混合物成分的关系并填入下表(不一定填满,表格不够也可自行增加):
a的取值范围 | 反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
Ⅱ.黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
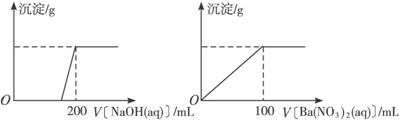
(1)请通过计算确定m值。
(2)X的摩尔质量为368 g·mol-1,请确定X的化学式。

