题目内容
氧化二氯是棕黄色刺激性气体,熔点:-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100),同时反应生成次氯酸溶液;制备出之后要冷却成固态以便操作和贮存.制备少量Cl2O,是用干燥的氯气和HgO反应(还生成HgO?HgCl2).装置示意如图(铁架台和夹持仪器已略去).

(1)A中盛有的深色固体试剂a是______,分液漏斗中试剂b是______
(2)B中盛有液体c是______,C中的液体d是______
(3)D中所发生反应的化学方程式是______
(4)E中的保温瓶中盛有致冷剂,它应是______(在干冰、冰水、液态空气中选择),在E的内管得到的氧化二氯中可能含有杂质是______
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是______,用这些不同的连接方式的主要理由是______.
解:(1)由装置图可知,A中发生反应制备氯气,反应不需加热,深色固体试剂a与溶液b反应,通常应为高锰酸钾与浓盐酸,故a为高锰酸钾,b为浓盐酸.
故答案为:高锰酸钾;浓盐酸.
(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥.故B中盛有液体c是试剂饱和食盐水,C中的液体d是浓硫酸.
故答案为:饱和食盐水;浓硫酸.
(3)由信息可知,D中氯气与HgO反应生成Cl2O与HgO?HgCl2.反应方程式为2HgO+2Cl2=Cl2O+HgO?HgCl2.
故答案为:2HgO+2Cl2=Cl2O+HgO?HgCl2.
(4)由题目信息可知,氧化二氯气体的熔点-116℃,熔点很低.所以选择沸点很低的液态空气进行制冷.
根据工艺流程可知,D中反应氯气可能不能成分反应,由于氯气易液化,所以E的内管得到的氧化二氯中可能含有杂质是液氯.
故答案为:液态空气;液氯.
(5)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,因此 Cl2O不能与有机物接触,所以A、B、C间用乳胶管连接,D、E间不能乳胶管连接.
故答案为:A、B、C间用乳胶管连接,D、E间不能乳胶管连接;Cl2O遇有机物易爆炸.
分析:(1)由装置图可知,A中发生反应制备氯气,反应不需加热,深色固体试剂a与溶液b反应,应为高锰酸钾与浓盐酸.
(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥.
(3)由信息可知,D中氯气与HgO反应生成Cl2O与HgO?HgCl2.
(4)由题目信息可知,氧化二氯气体的熔点-116℃,熔点很低.液态空气沸点-192℃,干冰冷却温度在-80℃左右,冰水为0℃.
根据工艺流程可知,D中反应氯气可能不能成分反应,且氯气易液化.
(5)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,D、E间不能用乳胶管连接.
点评:考查学生对实验原理及装置的理解、阅读题目获取信息的能力、以及充分利用所给信息设计合理的实验流程和实验条件控制能力等,关键是掌握整个制备流程原理,分析流程中各装置的作用.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.
故答案为:高锰酸钾;浓盐酸.
(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥.故B中盛有液体c是试剂饱和食盐水,C中的液体d是浓硫酸.
故答案为:饱和食盐水;浓硫酸.
(3)由信息可知,D中氯气与HgO反应生成Cl2O与HgO?HgCl2.反应方程式为2HgO+2Cl2=Cl2O+HgO?HgCl2.
故答案为:2HgO+2Cl2=Cl2O+HgO?HgCl2.
(4)由题目信息可知,氧化二氯气体的熔点-116℃,熔点很低.所以选择沸点很低的液态空气进行制冷.
根据工艺流程可知,D中反应氯气可能不能成分反应,由于氯气易液化,所以E的内管得到的氧化二氯中可能含有杂质是液氯.
故答案为:液态空气;液氯.
(5)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,因此 Cl2O不能与有机物接触,所以A、B、C间用乳胶管连接,D、E间不能乳胶管连接.
故答案为:A、B、C间用乳胶管连接,D、E间不能乳胶管连接;Cl2O遇有机物易爆炸.
分析:(1)由装置图可知,A中发生反应制备氯气,反应不需加热,深色固体试剂a与溶液b反应,应为高锰酸钾与浓盐酸.
(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥.
(3)由信息可知,D中氯气与HgO反应生成Cl2O与HgO?HgCl2.
(4)由题目信息可知,氧化二氯气体的熔点-116℃,熔点很低.液态空气沸点-192℃,干冰冷却温度在-80℃左右,冰水为0℃.
根据工艺流程可知,D中反应氯气可能不能成分反应,且氯气易液化.
(5)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,D、E间不能用乳胶管连接.
点评:考查学生对实验原理及装置的理解、阅读题目获取信息的能力、以及充分利用所给信息设计合理的实验流程和实验条件控制能力等,关键是掌握整个制备流程原理,分析流程中各装置的作用.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.

练习册系列答案
相关题目
利用化工厂生产硼砂的废渣--硼镁泥可制取七水硫酸镁(MgSO4?7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是______(选填序号).
a.被钝化 b.被氧化 c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为______.加热煮沸的目的是_______.
(3)沉淀B中除MnO2外还含有______(填化学式)等物质.
(4)沉淀C的化学式是______;产生沉淀C的操作需趁热进行的原因是______;洗涤沉淀需要的玻璃仪器有:烧杯、______;若用乙醇代替水作洗涤剂洗涤沉淀C,原因是______.
(5)过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有______,生产中对该滤液的处理方法是______;检验滤液是否含有SO42-操作是______.
根据下列实验内容得出的结论不正确的是
| 选项 | 实验内容 | 结论 |
| A | 向澄清石灰水中通入某气体,产生白色沉淀 | 该气体一定是CO2 |
| B | 向某溶液中滴加盐酸酸化的BaCl2产生白色沉淀 | 该溶液一定含SO42- |
| C | 向某盐的水溶液中加入氢氧化钠加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该盐一定是铵盐 |
| D | 向沸水中滴加饱和FeCl3溶液得到红褐色液体 | 该液体是Fe(OH)3胶体 |
- A.A
- B.B
- C.C
- D.D
 2H2O+O2↑
2H2O+O2↑ CaO+CO2↑
CaO+CO2↑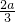 )
) )
)