题目内容
8.如图有关图示分析正确的是( )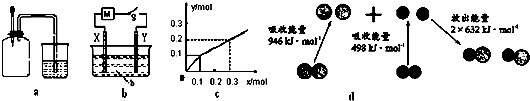
| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| C. | 如图b所示,X为铁棒,Y为铜棒,M为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入M | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,其热化学方程式为 N2(g)+O2(g)═2NO(g)△H=-180 kJ/mol |
分析 A、由图可知,烧杯中水进入集气瓶的原因是存在压强差;当气体能与液体反应或溶于液体时,造成瓶内部压强变小,从而使烧杯中的水进入集气瓶;
B、由图象可知,通电子0.1mol时生成0.1mol单质,应为M,通电子0.1mol~0.3mol电子时析出单质为0.1mol~0.2mol,由化合价可知应用氢气;
C、X极附近产生白色沉淀,说明Fe被氧化;
D、反应热为断开旧化学键吸收的能量与生成新化学键放出能量的差,据此计算.
解答 解:A、甲烷与氯气的取代产物一氯甲烷为气体,且不溶于水,故烧杯内水不可能充满集气瓶,故A错误;
B、由图象可知,通电子0.1mol时生成0.1mol单质,应为M,通电子0.1mol~0.3mol电子时析出单质为0.1mol~0.2mol,由化合价可知应用氢气,可知氧化性氧化能力M+>H+>N3+,故B错误;
C、X极附近产生白色沉淀,应为氢氧化亚铁,说明Fe被氧化,为阳极,则电子从X极流入a,故C正确;
D、热化学方程式为:N2(g)+O2(g)═2NO(g)△H=(946kJ/mol+498kJ/mol-2×632kJ/mol)=+180 kJ/mol,故D错误,故选C.
点评 本题考查实验装置的综合应用,为高频考点,涉及物质的制备、电解、化学反应与能量等,把握实验装置的作用为解答的关键,侧重分析、实验能力的考查,题目难度中等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
16.下列关于如图所示转化关系(X代表卤素)的说法错误的是( )


| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | △H1=△H2+△H3 | |
| C. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量按Cl、Br、I的顺序依次增多 | |
| D. | 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
3. 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )| A. | 电子经外电路自b极流向a极 | |
| B. | b极的电极半反应为O2+4e-+4H+=2H2O | |
| C. | 质子交换膜中的H+流向a极 | |
| D. | 以此电池供电,电解CuSO4溶液,理论上每生成0.1molCu最少需要氧气1.12L |
20.甲醇广泛用作燃料电池的燃料,可用天然气来合成.已知:
①2CH4 (g)+O2 (g)═2CO(g)+4H2(g)△H=-71.0 kJ•mol-1;
②CO(g)+2H2 (g)═CH3OH(l)△H=-90.5kJ•mol-1;
下列描述错误的是( )
①2CH4 (g)+O2 (g)═2CO(g)+4H2(g)△H=-71.0 kJ•mol-1;
②CO(g)+2H2 (g)═CH3OH(l)△H=-90.5kJ•mol-1;
下列描述错误的是( )
| A. | 反应①中的能量变化如图所示: | |
| B. | CO(g)+2H2 (g)═CH3OH(g)△H<-90.5kJ•mol-1 | |
| C. | 2CH4 (g)+3O2 (g)═2CO(g)+4H2O(g)△H<-71.0kJ•mol-1 | |
| D. | 2CH4 (g)+$\frac{1}{2}$O2 (g)═CH3OH( l))△H=-126.0kJ•mol-1 |
17.实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液、水 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
18. 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )| A. | 反应开始时,电子从甲池电极移向乙池电极 | |
| B. | 平衡时电流表指针为零,两池溶液颜色相同 | |
| C. | 平衡时Fe3+氧化性比I2强 | |
| D. | 平衡时向甲池中溶入FeCl2固体后,乙池的石墨电极为正极 |

 RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题:
RCH2CH=CH2$→_{hv}^{Br_{2}}$RCHBrCH=CH2.请按要求回答下列问题: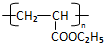 .
.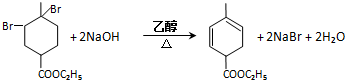 .
. 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为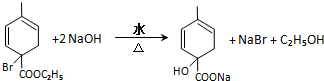 .
. .
.