题目内容
8.根据要求写出有关的化学方程式:A组:水,盐酸,氯化钡溶液,胆矾溶液
B组:铁,生石灰,烧碱溶液,硝酸银溶液
只准利用A组中的一种物质与B组中的一种物质起化学反应,每种物质只准利用一次,且符合下列要求,写出有关化学方程式:
(1)化合反应CaO+H2O=Ca(OH)2
(2)置换反应Fe+CuSO4=Cu+FeSO4
(3)中和反应NaOH+HCl═NaCl+H2O
(4)复分解反应2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2.
分析 (1)两种或两种以上物质生成一种物质的反应为化合反应;
(2)一种单质与一种化合物反应生成另外一种单质与另外一种化合物的反应为置换反应;
(3)酸与碱反应生成盐和水,此类反应为酸碱中和反应;
(4)两种物质相互交换阴阳离子的反应为复分解反应,据此概念解答即可.
解答 解:(1)生石灰与水反应生成氢氧化钙为化合反应,化学反应方程式为:CaO+H2O=Ca(OH)2,故答案为:CaO+H2O=Ca(OH)2;
(2)铁的活泼性强于铜,能与硫酸铜溶液反应置换出Cu,化学反应方程式为:Fe+CuSO4=Cu+FeSO4,故答案为:Fe+CuSO4=Cu+FeSO4;
(3)烧碱与盐酸反应生成氯化钠和水,化学反应方程式为:NaOH+HCl═NaCl+H2O,故答案为:NaOH+HCl═NaCl+H2O;
(4)硝酸银和氯化钡反应生成氯化银沉淀,属于复分解反应,化学反应方程式为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,故答案为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2.
点评 本题主要考查的是四大基本反应类型的概念以及化学反应方程式的书写,难度不大,为常考题.

练习册系列答案
相关题目
19.下列各组物质中,属于同系物的是( )
| A. | 苯和丙苯 | B. | 乙苯和间二甲苯 | C. | 丁二烯和丁烯 | D. | 萘和苯 |
13.下列分子或离子中,中心原子含有孤对电子的是( )
| A. | CH3+ | B. | CH3- | C. | SO42- | D. | NO3- |
20.工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质.工业冶炼铜的化学方程式是:8CuFeS2+2lO2 $\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
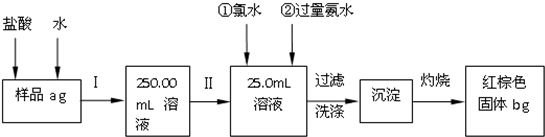
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.

①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
③滤液在酸性条件下,与H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和铜元素.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.

①滤液中的阳离子有Fe3+、Fe2+、H+、Al3+.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是c(填序号).
| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| C | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是1.5mol.
18.某Al2(SO4)3和Na2SO4的混合溶液中,已知c(Al3+):c(Na+)=1:2,若c(SO42-)=2.5 mol•L-1,则c(Al3+)为( )
| A. | 0.5 mol•L-1 | B. | l mol•L-1 | C. | 2 mol•L-1 | D. | 3 mol•L-1 |
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.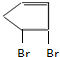 、
、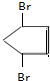 .
.