题目内容
物质的量相同的下列溶液中,含微粒种类最多的是( )
| A、CaCl2 |
| B、CH3COONa |
| C、NH4Cl |
| D、Na2S |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:盐类的水解专题
分析:这几种盐在水溶液里完全电离,弱离子在水溶液里水解,多元弱酸根离子分步水解,据此分析解答.
解答:
解:A.CaCl2溶液中所含粒子为Ca2+、Cl-、H2O、H+、OH-,共5种粒子;
B.CH3COONa溶液中,CH3COO-要水解,所含粒子为CH3COO-、Na+、H2O、H+、OH-、CH3COOH,共6种粒子;
C.NH4Cl水溶液中含有H+、OH-、NH3?H2O、NH4+、H2O、Cl-故6种粒子;
D、Na2S溶液中硫离子分步水解,含有Na+、S2-、HS-、OH-、H+、H2O、H2S,故7种;
上述溶液中含有粒子种类最多的是硫化钠溶液;
故选D.
B.CH3COONa溶液中,CH3COO-要水解,所含粒子为CH3COO-、Na+、H2O、H+、OH-、CH3COOH,共6种粒子;
C.NH4Cl水溶液中含有H+、OH-、NH3?H2O、NH4+、H2O、Cl-故6种粒子;
D、Na2S溶液中硫离子分步水解,含有Na+、S2-、HS-、OH-、H+、H2O、H2S,故7种;
上述溶液中含有粒子种类最多的是硫化钠溶液;
故选D.
点评:本题考查了盐类水解,根据盐类水解特点结合溶液中存在的微粒种类分析解答,知道多元弱酸根离子要分步水解,知道多元弱酸和多元弱碱水解的区别,题目难度不大.

练习册系列答案
相关题目
下列实验能获得成功的是( )
| A、苯、溴水、铁粉混合制成溴苯 |
| B、加浓溴水,然后过滤可除去苯中少量苯酚 |
| C、用高锰酸钾酸性溶液来区别甲烷和乙烯 |
| D、可用水来鉴别苯跟四氯化碳 |
物质的量相同的NH3和CH4两种气体,一定具有相同的( )
| A、体积 | B、质量 |
| C、原子个数 | D、质子数 |
单晶硅是信息产业中的重要基础材料,下列硅及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料
④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分.
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料
④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分.
| A、①③⑤ | B、①②④ |
| C、③④⑤ | D、①④⑤ |
下列叙述正确的是( )
| A、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B、常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4 |
| C、常温下,将0.2 mol?L-1的盐酸与等体积水混合后溶液pH=1 |
| D、常温下,将pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后溶液pH<7 |
下列叙述正确的是( )
| A、原子晶体中各相邻原子之间都以共价键结合 |
| B、分子晶体中都存在范德瓦耳斯力,分子内都存在共价键 |
| C、HF、HCl、HBr、HI四种物质的沸点依次升高 |
| D、干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
一定温度下可逆反应N2(g)+3H2(g)?2NH3(g) 达最大限度的标志是( )
| A、2v(N2)=v(NH3) | ||
| B、v正(N2)=3v正(H2) | ||
C、v正(H2)=
| ||
| D、v(N2):v( H2):v (NH3)=1:3:2 |
关于下列图示的说法中正确的是( )
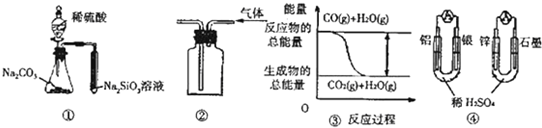

| A、用图 ①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B、用图 ②所示实验装置排空气法收集CO2气体 |
| C、图 ③表示CO(g)+H2O(g)?CO2(g)+H2(g)为吸热反应 |
| D、图 ④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |