题目内容
与主族元素在元素周期表中所处的位置有关的是( )
- A.相对原子质量
- B.核内中子数
- C.次外层电子数
- D.电子层数和最外层电子数
D
试题分析:在周期表中主族序数=最外层电子数,周期数=电子层数,所以与主族元素在元素周期表中所处的位置有关的是电子层数和最外层电子数,答案选D。
考点:考查元素周期表的结构以及周期表编制原则的判断
点评:该题主要是考查学生对元素周期表结构的熟悉了解程度,旨在巩固基础,提高能力。该题紧扣教材,注重基础,有利于培养学生的学习兴趣,提高学生的应试能力。
试题分析:在周期表中主族序数=最外层电子数,周期数=电子层数,所以与主族元素在元素周期表中所处的位置有关的是电子层数和最外层电子数,答案选D。
考点:考查元素周期表的结构以及周期表编制原则的判断
点评:该题主要是考查学生对元素周期表结构的熟悉了解程度,旨在巩固基础,提高能力。该题紧扣教材,注重基础,有利于培养学生的学习兴趣,提高学生的应试能力。

练习册系列答案
相关题目
(14分)X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息如下表:
| 元素 | 相关信息 |
| X | X原子核外最外层电子数是次外层的2倍 |
| Y | Y的气态氢化物的水溶液显弱碱性 |
| Z | Z是地壳中含量最多的金属元素 |
| W | 常温常压下,W的单质是淡黄色固体 |
| Q | …… |
 (1)元素Q在元素周期表中的位置______________________________.
(1)元素Q在元素周期表中的位置______________________________.(2)Y的最简单气态氢化物甲的水溶液可与H2O2发生反应,其产物不污染环境,化学方程式为______________________________________.(用元素符号表示,下同)
(3)X和氢元素组成的化合物分子有6个原子,其结构式为 .
(4)已知:X(s)+O2(g) =XO2(g) △H = -393.5kJ·mol-1
2X(s)+O2(g) ="2XO(g) " △H = -221.0kJ·mol-1
则XO的燃烧热的热化学方程式__________________________________________________.
(5)元素Y与氢元素形成的五核阳离子乙,向含乙和Z的阳离子的混合溶液中加入固体Na2O2,加入Na2O2的物质的量与产生沉淀有如图所示关系:
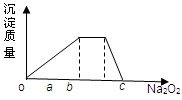
写出有关反应离子方程式:(每段只用一个离子方程式表示)
o—a段
a—b段 .
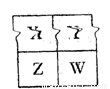
(22分)已知X、Y、Z三种短周期主族元素在元素周期表中的位置关系如图所示。
| Z | |
| Y | X |
(2)若X的单质是黄绿色气体,则X和Y的最高价氧化物对应的水化物的酸性强弱顺序为 (用化学式表示),和X同主族元素氢化物中熔沸点最高的是 (用化学式表示),原因是 ;X单质溶于水生成物之一具有漂白性,写出该物质结构式 。
(3)若X的单质与强酸、强碱溶液反应均能放出氢气,则元素X在周期表中的位置 写出X单质和烧碱溶液反应的离子方程式
探究X和Y两种元素金属性强弱的实验方法是 。
(4)若Y的氧化物是制造光导纤维的材料,则Y元素的名称是 ,
工业上利用单质Z和Y的氧化物高温下反应,生成一种具有空间立体网状结构的化合物,另一种生成物是有毒气体,写出反应化学方程式 。