题目内容
FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
| A.120N/a | B.120a/11N | C.11a/120N | D.120N/11a |
D
解析试题分析:agFeS2的物质的量为 mol,由方程式4FeS2+11O2
mol,由方程式4FeS2+11O2 2Fe2O3+8SO2可知,参加反应的氧气的物质的量为
2Fe2O3+8SO2可知,参加反应的氧气的物质的量为 mol×
mol× =
= mol。反应中氧元素化合价由0价降低为-2价,故转移电子物质的量为
mol。反应中氧元素化合价由0价降低为-2价,故转移电子物质的量为 mol×2×2=
mol×2×2= mol,所以N=
mol,所以N= mol×NA,故NA=
mol×NA,故NA= mol-1,答案选D。
mol-1,答案选D。
考点:考查氧化还原反应以及阿伏加德罗常数的有关计算

练习册系列答案
相关题目
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A.溶质的质量分数w=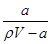 ×100% ×100% |
B.溶质的物质的量浓度c= mol·L-1 mol·L-1 |
C.溶液中c(OH-)=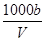 mol·L-1+c(H+) mol·L-1+c(H+) |
| D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w |
设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
| A.20mL 10 mol/L浓硫酸或浓硝酸与足量铜加热反应转移电子数均为0.2NA |
| B.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| C.标准状况下,2.24LCl2通人足量H2O或NaOH溶液中转移的电子数均为0.1NA |
| D.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |
设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,密度为d g/L的某气体纯净物一个分子的质量为 g g |
| B.常温常压下,17g甲基(—14CH3)所含的中子数为9NA |
| C.25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 |
| D.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
NA为阿伏加德罗常数,下列叙述正确的是
| A.10 g H18 2O含有的中子数为5NA |
| B.1 mol羟基(-OH)含有的电子数为10NA |
| C.1 mol 氯气参加反应时,电子转移数目一定为2NA |
| D.标准状况下,11.2L己烷含有的分子数为0.5NA |
某结晶水合物的化学式为R?nH2O,其相对分子质量为M。25℃时,将a g该晶体溶于b g H2O中恰好形成V mL饱和溶液。下列表达式正确的是
A.饱和溶液物质的量浓度为: 1000 a(M -18n) mol/L 1000 a(M -18n) mol/L |
B.饱和溶液溶质的质量分数为: |
C.25℃时R的溶解度为: g/100 g H2O g/100 g H2O |
D.饱和溶液的密度为: g/mL g/mL |
下列化学用语正确的是( )
A.14C原子结构示意图: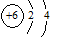 |
B.硝基苯的结构简式: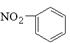 |
C.NH4Cl的电子式: |
| D.FeS2中S的化合价:?2 |