题目内容
某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质.
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取w g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3mol?L-1的 Na2S2O3溶液滴定(滴定时的反应方程式:
I2+2S2O32-═2I-+S4O62-).操作b涉及的主要反应的离子方程式为 ;滴定时,Na2S2O3溶液应放在 (填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00mL,其终点颜色变化为 ;加碘食盐样品中的碘元素含量是 mg?kg-1(以含w的代数式表示).
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示): .由学生乙的实验结果推知,学生甲的实验结果将 (填“偏大、偏小或无影响”).
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取w g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3mol?L-1的 Na2S2O3溶液滴定(滴定时的反应方程式:
I2+2S2O32-═2I-+S4O62-).操作b涉及的主要反应的离子方程式为
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴入淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)依据碘酸根氧化碘离子发生氧化还原反应书写离子方程式;依据盐类水解分析判断,Na2S2O3为强碱弱酸盐;碘单质遇淀粉显蓝色,当碘单质消耗,蓝色褪去;根据反应找出反应关系式,然后根据题中数据计算出加碘食盐样品中的碘元素含量;
(2)酸性条件下,碘离子被氧气氧化生成碘单质;过量的碘离子易被空气氧化生成碘单质,导致测定结果偏大.
(2)酸性条件下,碘离子被氧气氧化生成碘单质;过量的碘离子易被空气氧化生成碘单质,导致测定结果偏大.
解答:
解:(1)用稀硫酸酸化,再加入过量KI溶液,在酸性条件下碘酸根氧化碘离子生成碘单质,所以离子方程式为:5I-+IO3-+6H+=3I2+3H2O;Na2S2O3为强碱弱酸盐,因为硫代硫酸根离子水解,Na2S2O3溶液呈弱碱性,所以滴定时Na2S2O3溶液应放在碱性滴定管中;b中生成I2,c中使用淀粉作为指示剂,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色,滴定终点现象为:蓝色变无色,且保持半分钟不变色;
20mL溶液消耗Na2S2O3的物质的量为1.00×10-3mol/L×0.02L=2.00×10-5mol,根据IO3-+5I-+6H+=3I2+3H2O,I2+2S2O32-=2I-+S4O62-,则:
IO3-~3I2~6S2O32-,
1 6
xmol 2.00×10-5mol
所以x=
故加碘食盐样品中的碘元素的质量是
×127g/mol×103mg/g=
mg,所以加碘食盐样品中的碘元素含量为
=
mg/kg,
故答案为:5I-+IO3-+6H+=3I2+3H2O;碱式滴定管;蓝色变无色,且保持半分钟不变色;
;
(2)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O,酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,故答案为:4I-+4H++O2=2I2+2H2O;偏大.
20mL溶液消耗Na2S2O3的物质的量为1.00×10-3mol/L×0.02L=2.00×10-5mol,根据IO3-+5I-+6H+=3I2+3H2O,I2+2S2O32-=2I-+S4O62-,则:
IO3-~3I2~6S2O32-,
1 6
xmol 2.00×10-5mol
所以x=
| 2.00×10 -5mol |
| 6 |
| 2.00×10 -5mol |
| 6 |
| 127×10 -2 |
| 3 |
| ||
| W×10 -3kg |
| 1270 |
| 3w |
故答案为:5I-+IO3-+6H+=3I2+3H2O;碱式滴定管;蓝色变无色,且保持半分钟不变色;
| 1270 |
| 3w |
(2)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O,酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,故答案为:4I-+4H++O2=2I2+2H2O;偏大.
点评:本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,为易错点.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列叙述中,正确的是( )
| A、非极性分子一定不含极性键 |
| B、共价化合物中可能含有离子键 |
| C、离子化合物中可能含有共价键 |
| D、非极性分子中一定含有非极性键 |
当光束通过下列物质时,能观察到丁达尔效应的是( )
| A、NaCl溶液 |
| B、CuSO4溶液 |
| C、NaOH溶液 |
| D、Fe(OH)3胶体 |
2011年11月3日我国自主研制的天宫一号目标飞行器与神舟八号飞船成功实现首次交会对接,标志着我国的载人航天事业进入了一个新的高度.这次任务中的天地话音系统是新研制的设备,由于采用光纤传输取代了以前使用的无线传输,从而避免了多径效应干扰,使得待发段的语音和画面质量更加清晰.光纤的主要成分中含有硅元素,下列关于28Si、29Si、30Si的说法中正确的是( )
| A、28Si、29Si、30Si 是不同元素的三种原子 |
| B、28Si、29Si、30Si 互称为同位素 |
| C、28Si、29Si、30Si 分别含有14、15、16个质子 |
| D、28Si、29Si、30Si都含有14个中子 |
下列实验操作中叙述正确的是( )
| A、萃取操作必须在分液漏斗中进行 |
| B、用酒精灯直接加热蒸馏烧瓶 |
| C、用剩的药品应收集起来放回原试剂瓶中 |
| D、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |

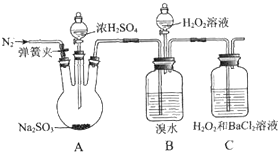 为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).