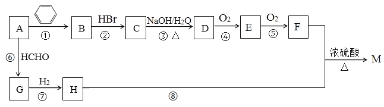
题目内容
【题目】向![]() 溶液中,逐渐加入铁粉至过量
溶液中,逐渐加入铁粉至过量![]() 假设生成的气体只有一种
假设生成的气体只有一种![]() ,在此过程中,
,在此过程中,![]() 随
随![]() 变化如图所示,试回答下列问题:
变化如图所示,试回答下列问题:
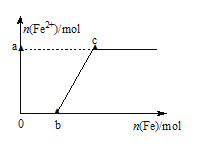
(1)写出![]() 段的离子方程式:_______________。
段的离子方程式:_______________。
(2)a=__________,![]() ___________;
___________;
(3)写出向c点处的反应液中加入稀盐酸后的离子方程式:________________。
(4)当加入铁粉nmol时![]() ,溶液中Fe
,溶液中Fe![]() 的物质的量为_____________
的物质的量为_____________![]() 用含n的式子表示
用含n的式子表示![]()
【答案】![]()
![]()
![]()
![]()
![]()
【解析】
![]() 由已知图象知:当
由已知图象知:当![]() 时亚铁离子物质的量为0,说明铁和稀硝酸反应生成硝酸铁,其离子方程式为:
时亚铁离子物质的量为0,说明铁和稀硝酸反应生成硝酸铁,其离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 因为生成的气体只有一种,生成
因为生成的气体只有一种,生成![]() 的还原产物是一氧化氮,氧化性硝酸占整个硝酸的
的还原产物是一氧化氮,氧化性硝酸占整个硝酸的![]() ,所以做氧化剂的硝酸的物质的量为:
,所以做氧化剂的硝酸的物质的量为:![]() ,根据转移电子的物质的量相等,所以亚铁离子的物质的量为:
,根据转移电子的物质的量相等,所以亚铁离子的物质的量为:![]() ,所以
,所以![]() ,当硝酸与铁单质恰好完全反应时,生成硝酸铁,根据化学方程式:
,当硝酸与铁单质恰好完全反应时,生成硝酸铁,根据化学方程式:![]() ,消耗铁的物质的量为:
,消耗铁的物质的量为:![]() ,则
,则![]() ,
,
故答案为:![]() ;
; ![]() ;
;
![]() 因为c点处的溶液中只存在亚铁离子和硝酸根,向c点处的反应液中加入稀盐酸后,氢离子、硝酸根离子和亚铁离子又会继续发生氧化还原反应,产生NO气体,其离子方程式为:
因为c点处的溶液中只存在亚铁离子和硝酸根,向c点处的反应液中加入稀盐酸后,氢离子、硝酸根离子和亚铁离子又会继续发生氧化还原反应,产生NO气体,其离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 硝酸的物质的量为:
硝酸的物质的量为:![]() ,硝酸与铁反应生成铁离子过程中,氧化性的硝酸的物质的量为:
,硝酸与铁反应生成铁离子过程中,氧化性的硝酸的物质的量为: ,所以硝酸得到电子的物质的量为
,所以硝酸得到电子的物质的量为![]() ,
,![]() ,则根据电子转移相等,
,则根据电子转移相等,![]() ,根据铁元素守恒可得:
,根据铁元素守恒可得:![]() ,
,![]() ,两式联立解得:
,两式联立解得:![]() ,
,
故答案为:![]() 。
。

【题目】将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)。下列计算结果正确的是
编号 | ① | ② | ③ | ④ |
硝酸体积/mL | 100 | 200 | 300 | 400 |
剩余金属/g | 18.0 | 9.6 | 0 | 0 |
NO体积/L | 2.24 | 4.48 | 6.72 | V |
A. ①中溶液存在Fe3+ B. 硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D. ④中V=6.72
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
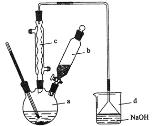
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是___;装置d的作用是___。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c的目的是___。
②利用温度计控制温度,适宜的温度范围为(填序号)___。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。操作②所需要的玻璃仪器除烧杯外,还需___,滤液用NaOH溶液洗涤的作用是___。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中溶解的主要杂质为苯,要进一步提纯,下列操作中必须的是___(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取