题目内容
|
25℃时,101 kPa时,1 g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量,下列表示该反应的热化学方程式正确的是 | |
A. |
CH4O(1)+ |
B. |
2CH4O(1)+3O2(g) |
C. |
2CH4O+3O2 |
D. |
CH4O(1)+ |
答案:A
解析:
解析:
|
根据题意,燃烧1 mol甲醇,放出的热量应为22.68×46=725.8 kJ,故A正确.B中CH4O应为1 mol,且放出热量ΔH应为负值;C中未标明物质聚集状态,ΔH也不正确;D中H2O应为液态. |

练习册系列答案
相关题目
化学反应速率与反应物浓度的关系式(称为速率方程)是通过实验测定的,以反应aA+dD eE为例,可先假设该反应的速率方程为v=kcm(A)cn(D),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程。现测得
eE为例,可先假设该反应的速率方程为v=kcm(A)cn(D),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程。现测得25 ℃ 时溶液中的反应3X+2Y 2Z在不同浓度时的反应速率如下表:
2Z在不同浓度时的反应速率如下表:
| c(X)/ mol·L-1 | c(Y)/ mol·L-1 | v/ mol·L-1·s-1 |
1 | 0.10 | 0.10 | 4.0×10-4 |
2 | 0.20 | 0.10 | 1.6×10-3 |
3 | 0.30 | 0.10 | 3.6×10-3 |
4 | 0.30 | 0.20 | 7.2×10-3 |
根据以上实验数据,完成下列问题:
(1)上述反应在
(2)当c(X)=c(Y)=0.25 mol·L-1时,v=_______________。
 (aq)+
(aq)+ (aq)+2
(aq)+2 (aq) = BaSO4(s)+2H
(aq) = BaSO4(s)+2H O(l);
O(l);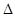 H =
H = 57.3 kJ/mol
57.3 kJ/mol H
H O
O 57.3 kJ/mol
57.3 kJ/mol H2 SO4(aq)=
H2 SO4(aq)= O2(g)=8CO2(g)+9H2O △H=
O2(g)=8CO2(g)+9H2O △H= (aq)+
(aq)+ (aq)+2OH
(aq)+2OH (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H O(1)
O(1) H=
H= 57.3 kJ/mol
57.3 kJ/mol B.KOH(aq)+
B.KOH(aq)+ H2SO4(aq)=
H2SO4(aq)=
 O
O H=
H= 57.3kJ/mol
57.3kJ/mol B.KOH(aq)+
B.KOH(aq)+ H2SO4(aq)=
H2SO4(aq)=  O2 (g)=8CO2 (g)+
9H2O(g)
O2 (g)=8CO2 (g)+
9H2O(g)