题目内容
实验室用8.7g二氧化锰与足量的浓盐酸反应制取氯气.
求:(1)可制得标准状况下的氯气的体积;
(2)被氧化的浓盐酸物质的量.
解:(1)n(MnO2)=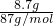 =0.1mol,设生成氯气的体积为V,则
=0.1mol,设生成氯气的体积为V,则
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol 22.4L
0.1mol V
V= =2.24L,
=2.24L,
答:可制得标准状况下的氯气的体积为2.24L;
(2)根据化合价的变化可知,在MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O反应中,当有4molHCl参加反应时,有2molHCl被氧化,则
MnCl2+Cl2↑+2H2O反应中,当有4molHCl参加反应时,有2molHCl被氧化,则
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 被氧化的HCl
MnCl2+Cl2↑+2H2O 被氧化的HCl
1mol 2mol
0.1mol 0.2mol
答:被氧化的浓盐酸物质的量为0.2mol.
分析:n(MnO2)=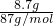 =0.1mol,二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)
=0.1mol,二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,在反应中,盐酸不全部被氧化,部分表现为酸性,结合反应的化学方程式计算.
MnCl2+Cl2↑+2H2O,在反应中,盐酸不全部被氧化,部分表现为酸性,结合反应的化学方程式计算.
点评:本题考查氯气的性质和氧化还原反应的计算,题目难度不大,注意根据反应的化学方程式计算,本题中要特别注意参加反应的盐酸与被氧化的盐酸的物质的量的关系.
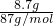 =0.1mol,设生成氯气的体积为V,则
=0.1mol,设生成氯气的体积为V,则MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O1mol 22.4L
0.1mol V
V=
 =2.24L,
=2.24L,答:可制得标准状况下的氯气的体积为2.24L;
(2)根据化合价的变化可知,在MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O反应中,当有4molHCl参加反应时,有2molHCl被氧化,则
MnCl2+Cl2↑+2H2O反应中,当有4molHCl参加反应时,有2molHCl被氧化,则MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O 被氧化的HCl
MnCl2+Cl2↑+2H2O 被氧化的HCl1mol 2mol
0.1mol 0.2mol
答:被氧化的浓盐酸物质的量为0.2mol.
分析:n(MnO2)=
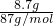 =0.1mol,二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)
=0.1mol,二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,在反应中,盐酸不全部被氧化,部分表现为酸性,结合反应的化学方程式计算.
MnCl2+Cl2↑+2H2O,在反应中,盐酸不全部被氧化,部分表现为酸性,结合反应的化学方程式计算.点评:本题考查氯气的性质和氧化还原反应的计算,题目难度不大,注意根据反应的化学方程式计算,本题中要特别注意参加反应的盐酸与被氧化的盐酸的物质的量的关系.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目