题目内容
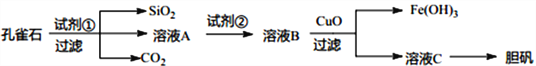
【题目】短周期元素A、B、C、D、E的原子序数依次增大。已知:
①C的简单气态氢化物遇湿润的红色石蕊试纸变蓝色;
②A与D可以形成原子个数比分别为2∶1、1∶1的两种液态化合物X和Y,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种化合物F,其组成原子数之比为5∶1∶1∶3。
请回答下列问题:
(1)C原子在周期表的位置为_____________;D的原子结构示意图为_____________;写出化合物EDA的电子式__________。
(2)C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐,写出其化学式___________;写出Y的结构式_____________。
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为_______________________。
(4)氯气与C的简单气态氢化物相遇有白烟及C2生成,写出反应方程式______________。
(5)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ·mol-1
N2O4(g) ΔH=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:____________________ 。
【答案】 第二周期第VA族 ![]()
![]() NH4NO3 H—O—O—H HCO3-+NH4++2OH-
NH4NO3 H—O—O—H HCO3-+NH4++2OH-![]() CO32-+H2O+NH3·H2O 8NH3+3Cl2
CO32-+H2O+NH3·H2O 8NH3+3Cl2![]() N2+6NH4Cl CH4(g)+N2O4(g)
N2+6NH4Cl CH4(g)+N2O4(g)![]() N2(g)+2H2O(l)+CO2(g) ΔH=-898.1 kJ·mol-1
N2(g)+2H2O(l)+CO2(g) ΔH=-898.1 kJ·mol-1
【解析】短周期元素A、B、C、D、E的原子序数依次增大。①C的简单气态氢化物遇湿润的红色石蕊试纸变蓝色,为氨气,则C为N元素;②A与D可以形成原子个数比分别为2∶1、1∶1的两种液态化合物X和Y,分别为水和过氧化氢,则A为H元素,D为O元素;A、E同主族,则E为Na元素,C与B、D相邻,则B为C元素;③A、B、C、D四种元素组成一种化合物F,其组成原子数之比为5∶1∶1∶3,F为NH4HCO3。
(1)C为N元素,在周期表中位于第二周期第VA族;D为O元素,O原子的原子结构示意图为![]() ;化合物EDA为NaOH,属于离子化合物,电子式为
;化合物EDA为NaOH,属于离子化合物,电子式为![]() ,故答案为:第二周期第VA族 ;
,故答案为:第二周期第VA族 ; ![]() ;
; ![]() ;
;
(2)硝酸与氨气化合生成NH4NO3;Y为过氧化氢,结构式为H—O—O—H,故答案为:NH4NO3;H—O—O—H;
(3) F为NH4HCO3,与足量NaOH的稀溶液混合,离子方程式为HCO3-+NH4++2OH-![]() CO32-+H2O+NH3·H2O,故答案为:HCO3-+NH4++2OH-
CO32-+H2O+NH3·H2O,故答案为:HCO3-+NH4++2OH-![]() CO32-+H2O+NH3·H2O;
CO32-+H2O+NH3·H2O;
(4)氯气与氨气相遇有白烟——氯化铵及N2生成,反应方程式为8NH3+3Cl2![]() N2+6NH4Cl,故答案为:8NH3+3Cl2
N2+6NH4Cl,故答案为:8NH3+3Cl2![]() N2+6NH4Cl;
N2+6NH4Cl;
(5) ①CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1,②2NO2(g)
N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1,②2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ·mol-1,根据盖斯定律,将①-②得:CH4(g)+N2O4(g)
N2O4(g) ΔH=-56.9 kJ·mol-1,根据盖斯定律,将①-②得:CH4(g)+N2O4(g)![]() N2(g)+2H2O(l)+CO2(g) ΔH=(-955 kJ·mol-1)-(-56.9 kJ·mol-1)=-898.1 kJ·mol-1,故答案为:CH4(g)+N2O4(g)
N2(g)+2H2O(l)+CO2(g) ΔH=(-955 kJ·mol-1)-(-56.9 kJ·mol-1)=-898.1 kJ·mol-1,故答案为:CH4(g)+N2O4(g)![]() N2(g)+2H2O(l)+CO2(g) ΔH=-898.1 kJ·mol-1。
N2(g)+2H2O(l)+CO2(g) ΔH=-898.1 kJ·mol-1。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________。
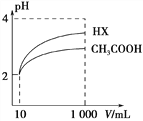
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)___醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___Ka(CH3COOH)(填“>”、“=”或“<”)。
(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________(用离子符号表示)
【题目】溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:

步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中,充分反应。,有___________(填现象)产生; 将b中的液溴慢慢加入到a中,而不能快速加入的原因是___________,继续滴加液溴滴完。装置d的作用是___________________;
步骤2:向a中加入10 mL水,然后________(填操作名称)除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤,分液得粗溴苯。NaOH溶液洗涤的作用是____________;
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。加入氯化钙的目的是______________;
已知苯、溴苯的有关物理性质如上表:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)实验装置中,仪器c的名称为_____,作用是冷凝回流,回流的主要物质有___________________(填化学式)
(2)步骤4得到的粗产品中还含有杂质苯,,则要进一步提纯粗产品,还必须进行的实验操作名称是__________________。