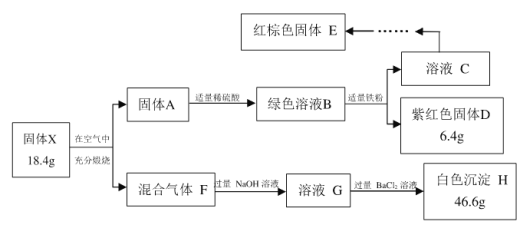
题目内容
【题目】下列说法正确的是( )
A.将海水中钢闸门连接电源正极可防止其被腐蚀
B.常温下,向![]() 溶液中加入少量
溶液中加入少量![]() 固体,溶液中
固体,溶液中 值减小
值减小
C.反应![]() 浓
浓![]() 的
的![]() ,
,![]()
D.对硫酸工业中的反应:![]() ,采用
,采用![]() 左右的高温主要是为了加快反应速率
左右的高温主要是为了加快反应速率
【答案】B
【解析】
A.将海水中钢铁闸门与电源的负极相连,铁是阴极,被保护,可防止闸门被腐蚀,将海水中钢铁闸门与电源的正极相连,铁作电解池阳极,加速被腐蚀,故A错误;
B.常温下,向Na2CO3溶液中加入少量Ca(OH)2固体,溶液中氢氧根离子浓度增大,溶液中 =
=![]() 值减小,故B正确;
值减小,故B正确;
C.反应![]() 浓
浓![]() 的
的![]() ,故C错误;
,故C错误;
D.![]() ,这是一个放热反应,升高温度平衡会向逆方向移动,不利于生成三氧化硫,采用
,这是一个放热反应,升高温度平衡会向逆方向移动,不利于生成三氧化硫,采用![]() 左右的高温是因为催化剂在此温度下活性最大,故D错误;
左右的高温是因为催化剂在此温度下活性最大,故D错误;
故答案选B。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
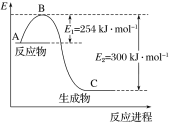
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
【题目】某温度下,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X Y Z |
初始浓度/mol·L-1 | 0.1 0.2 0 |
平衡浓度/mol·L-1 | 0.05 0.05 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z
2Z
C.平衡常数 K = 1600 mol-2·L2
D.增大压强和升高温度,平衡正方向移动