题目内容
下列热化学方程式及说法正确的是
- A.CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) △H= —890KJ
- B.丁烷的燃烧热是2878 kJ/mol,则:
C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(g)△H= —2878kJ/mol - C.2 mol氢气燃烧生成水蒸气放出484 kJ热量,
则:H2O(g)=H2(g)+1/2O2(g);△H=+242 kJ·mol-1 - D.CH3COOH(aq)+KOH(aq)=CH3COOK(aq)+H2O(l)△H=-akJ·mol-1,a就为中和热的值
B
试题分析:A项:△H的单位是kJ/mol,故错;C项:反应是放热反应,△H<0,故错;D项:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,故错,选B。
考点:热化学方程式
点评:本题考查了热化学方程式的书写方法和注意问题,标注物质的聚集状态和反应的焓变是书写基本要求,题目较简单。
试题分析:A项:△H的单位是kJ/mol,故错;C项:反应是放热反应,△H<0,故错;D项:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,故错,选B。
考点:热化学方程式
点评:本题考查了热化学方程式的书写方法和注意问题,标注物质的聚集状态和反应的焓变是书写基本要求,题目较简单。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
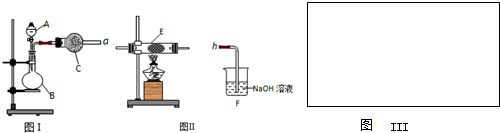


 CH3OH(g)+H2O(g)△H=-49.0kJ/mol 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol 测得CO2和CH3OH(g)的浓度随时间变化如图所示。 
 2NH3(g)
2NH3(g)