题目内容
下列说法不正确的是 ( )
A、对硝基甲苯的结构简式为: |
| B、“地沟油”禁止食用,但可以用来制肥皂 |
| C、升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D、H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol不是氢气的燃烧热方程式 |
考点:结构简式,热化学方程式,化学反应速率的影响因素,油脂的性质、组成与结构
专题:化学反应中的能量变化,有机化学基础
分析:A.硝基中氮原子与苯环上的碳原子相连;
B.地沟油对人体健康有害,可作为工业原料;
C.升高温度,提供了分子能量,增大了活化分子百分数;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量.
B.地沟油对人体健康有害,可作为工业原料;
C.升高温度,提供了分子能量,增大了活化分子百分数;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量.
解答:
解:A.硝基中氮原子与苯环上的碳原子相连,对硝基甲苯的结构简式为: ,故A错误;
,故A错误;
B.地沟油对人体健康有害,可作为工业原料,属于酯类物质,可用于制取肥皂、汽油、柴油等,故B正确;
C.升高温度,升高了分子能量,增大了活化分子百分数,因而反应速率增大,故C正确;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol不是氢气的燃烧热的热方程式,故D正确;
故选A.
 ,故A错误;
,故A错误;B.地沟油对人体健康有害,可作为工业原料,属于酯类物质,可用于制取肥皂、汽油、柴油等,故B正确;
C.升高温度,升高了分子能量,增大了活化分子百分数,因而反应速率增大,故C正确;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol不是氢气的燃烧热的热方程式,故D正确;
故选A.
点评:本题考查结构简式,地沟油的运用,温度对速率的影响,燃烧热等,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目
在空气中易被氧化的是( )
| A、Na2SO3 |
| B、盐酸 |
| C、浓硫酸 |
| D、稀硫酸 |
某烯烃与H2加成后的产物是: ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A、3种 | B、4种 | C、5种 | D、6种 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、生成物能量一定低于反应物总能量 |
| B、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| C、根据盖斯定律,可计算某些难以直接测定的化学反应的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
下列有关说法中正确的是( )
| A、乙烯使溴水、酸性高锰酸钾溶液褪色的原理相同 |
| B、乙醇可被直接氧化生成乙酸且乙醇与都能与单质钠反应 |
| C、淀粉、蔗糖、葡萄糖、蛋白质在稀硫酸中均能发生水解反应 |
| D、淀粉和聚乙烯都是天然的高分子化合物 |
对下列有机反应类型的认识中,不正确的是( )
A、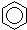 +HNO3 +HNO3
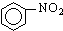 +H2O;取代反应 +H2O;取代反应 | |||
| B、CH4+Cl2→CH3Cl+HCl;置换反应 | |||
C、CH2═CH2+H2O
| |||
D、2CH3CH2OH+O2
|
下列排列顺序不正确的是( )
| A、原子半径:钠>磷>氟>氢 |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、热稳定性:碘化氢>溴化氢>氟化氢 |
| D、还原性:S2->Cl->F- |
 A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
