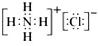题目内容
(2011?许昌模拟)下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
分析:碱性溶液中,离子之间不能结合生成水、气体、沉淀等,则离子能共存;强酸溶液中该组离子能发生氧化还原反应,即为正确答案.
解答:解:A.碱性溶液中,OH-与Mg2+结合生成沉淀,则不能共存,故A不选;
B.碱性溶液中,该组离子之间不反应,能共存,但加入酸不发生氧化还原反应,故B不选;
C.碱性溶液中,该组离子之间不反应,能共存,且加入酸时H+、NO3-、SO32-发生氧化还原反应,故C选;
D.碱性溶液中,OH-与NH4+结合生成弱电解质,则不能共存,故D不选;
故选C.
B.碱性溶液中,该组离子之间不反应,能共存,但加入酸不发生氧化还原反应,故B不选;
C.碱性溶液中,该组离子之间不反应,能共存,且加入酸时H+、NO3-、SO32-发生氧化还原反应,故C选;
D.碱性溶液中,OH-与NH4+结合生成弱电解质,则不能共存,故D不选;
故选C.
点评:本题考查离子共存问题,熟悉习题中的信息及离子之间的反应即可解答,熟悉酸碱条件下的反应是解答本题的关键,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目





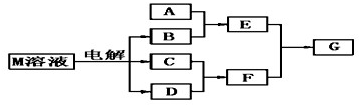
 (4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式
(4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式