题目内容
将pH=9的![]() 溶液和pH=12的NaOH溶液按4∶1的体积比混合,则室温时混合液的
溶液和pH=12的NaOH溶液按4∶1的体积比混合,则室温时混合液的![]() 为
为
[
]

常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
P H=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________ (选填“是”或“否”)。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________。
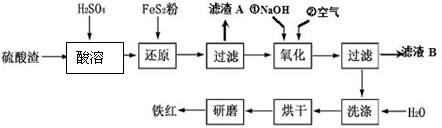
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
 方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
有关离子完全沉淀的p H如下表。
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
请回答下列问题:
(1)在②中调节pH的范围至 为最好。(填序号)
A.3~4 B.6~8 C.10~11 D.12~14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(3)写出此阴极反应的电极方程式 。现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
 和
和

