题目内容
【题目】在体积为2L的恒容密闭容器中,充入2molCO2和6molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
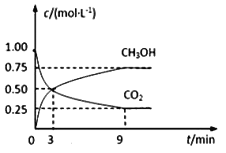
(1)0~9min内,v(H2)=__mol·L1·min1。
(2)能说明上述反应达到平衡状态的是__(填编号)。
a.反应中CO2与CH3OH的物质的量浓度之比为1:1
b.混合气体的密度不随时间的变化而变化
c.单位时间内消耗3 mol H2,同时生成1 mol H2O
d.CO2的体积分数在混合气体中保持不变
e.混合气体的压强不随时间的变化而变化
(3)平衡时H2的转化率为___。
(4)平衡时混合气体中H2O(g)的体积分数是__。
(5)一定温度下,第9分钟时v正(CH3OH)__(填“大于”、“小于”或“等于”)第3分钟时v逆 (CH3OH)。
【答案】0.25 de 75% 30% 大于
【解析】
(1)可先求出0~9min内v(CO2),然后利用速率之比等于化学计量数之比,求出v(H2)。
(2)a.反应中CO2与CH3OH的物质的量浓度之比为1:1,不能确定反应是否达平衡状态;
b.反应前后混合气的质量不变,体积不变,则混合气体的密度始终不变;
c.单位时间内消耗3 mol H2,同时生成1 mol H2O,此关系适合于反应进行中的任意阶段;
d.CO2的体积分数在混合气体中保持不变,表明反应达平衡状态;
e.平衡前,混合气体的压强随时间的变化而变化,只有平衡时压强才不发生改变。
(3)利用三段式,可求出H2的变化量,从而求出平衡时H2的转化率。
(4) 利用三段式,可求出H2O的变化量,也就是平衡量,从而求出平衡时混合气体中H2O(g)的体积分数。
(5)随着反应的进行,正反应速率不断减小,逆反应速率不断增大,但平衡前,正反应速率始终大于逆反应速率。
(1)0~9min内v(CO2)=![]() =
=![]() mol·L1·min1,v(H2)=3v(CO2)= 0.25mol·L1·min1。答案为:0.25;
mol·L1·min1,v(H2)=3v(CO2)= 0.25mol·L1·min1。答案为:0.25;
(2)a.反应中CO2与CH3OH的物质的量浓度之比为1:1,不能确定反应是否达平衡状态,a不合题意;
b.反应前后混合气的质量不变,体积不变,则混合气体的密度始终不变,所以密度不变时反应不一定达平衡状态,b不合题意;
c.单位时间内消耗3 mol H2,同时生成1 mol H2O,此关系适合于反应进行中的任意阶段,所以不一定达平衡状态,c不合题意;
d.CO2的体积分数在混合气体中保持不变,表明反应达平衡状态,d符合题意;
e.平衡前,混合气体的压强随时间的变化而变化,只有平衡时压强才不发生改变,e符合题意。答案为:de;
(3)
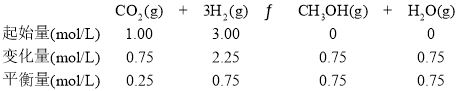
平衡时H2的转化率为![]() =75%。答案为:75%;
=75%。答案为:75%;
(4)平衡时混合气体中H2O(g)的体积分数为![]() =30%。答案为:30%;
=30%。答案为:30%;
(5)随着反应的进行,正反应速率不断减小,逆反应速率不断增大,但平衡前,正反应速率始终大于逆反应速率。由一定温度下,第9分钟时v正(CH3OH)大于第3分钟时v逆 (CH3OH)。答案为:大于。