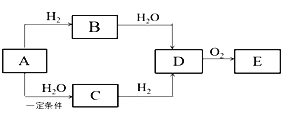
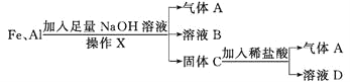
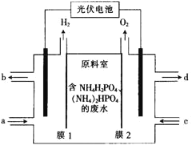
题目内容
【题目】下列关于物质的组成、结构或性质的叙述中,正确的是
①HF的稳定性很强,是因为其分子间能形成氢键
②基态原子价电子排布式为(n-1)d6~8ns2的元素属于第ⅧB族
③能层为1时,有自旋方向相反的两个轨道
④“量子化”就是连续的意思,微观粒子运动均有此特点
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有5种
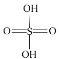
⑥次氯酸分子的电子式:![]()
⑦氯离子与硫离子的核外电子排布相同,都是1s22s22p63s23p6,两粒子的3p能级上的电子离核的距离相同
⑧S2-、Cl-、K+、Na+半径逐渐减小
⑨最外层有3个未成对电子的原子一定属于主族元素
A.①③④⑦⑧B.⑤⑧⑨C.②③⑤⑥⑦⑨D.②⑦⑧⑨
【答案】B
【解析】
①HF的稳定性很强,是由于H-F键键能较大的原因,与氢键无关,故①错误;
②原子的价电子排布为(n-1)d6-8ns2的元素为Ⅷ族元素,而不是第ⅧB族,故②错误;
③能层为1时,只有一个1s轨道,有自旋相反的两个电子,故③错误;
④微观粒子的运动具有波粒二象性,用波粒二象性和概率波处理微观问题就是量子化,微观粒子的运动具有量子化特点,故④错误;
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素和价电子构型分别是:氢(1s1)、碳(2s22p2)、氧(2s22p4)、磷(3s23p3)、铁(3d64s2共5种元素,故⑤正确;
⑥次氯酸分子中含有O-H键,次氯酸分子的电子式为![]() ,故⑥错误;
,故⑥错误;
⑦同是3P能级,氩原子中的核电荷数较大,对电子的引力大,所以电子离核较近,故⑦错误;
⑧电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,则S2-、Cl-、K+、Na+半径逐渐减小,故⑧正确;
⑨最外层有3个未成对电子的原子,最外层电子排布为ns2np3,p轨道上3个电子为未成对电子,位于第VA族,为主族元素,故⑨正确;
⑤⑧⑨正确,故答案为B。

 阅读快车系列答案
阅读快车系列答案