题目内容
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4 和极少量的PbO2)和稀H2SO4 为原料制备高纯PbO 的工艺流程如下:
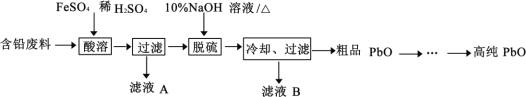
(1)铅蓄电池放电时负极的电极反应________。
(2)酸溶过程中含铅废料需要粉碎,其目的是__________,在 Fe2+催化下,PbO2 和Pb 反应生成PbSO4,生成 1molPbSO4 转移电子的物质的量__________mol。
(3)滤液A 中含有的主要阳离子是______(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为______。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是______
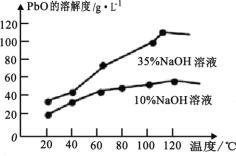
(6)PbO 溶解在NaOH 溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
NaHPbO2(aq) 。 PbO 的溶解度曲线如图所示。结合该曲线,简述由粗品PbO 得到高纯PbO 的操作:将粗PbO 溶解在一定量______(填“35%”或“ 10%)NaOH 溶液中,加热至 110℃左右,充分溶解后,_______,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO。
【答案】Pb-2e- + SO42-=PbSO4 增大固体表面积,提高反应速率 1mol H+ 、Fe2+ PbSO4 +2OH-=PbO+SO4 2-+H 2O 取最后一次洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次洗涤液滴入盐酸和氯化钡溶液,若不产生沉淀),说明已洗涤干净 35% 趁热过滤
【解析】
(1)铅蓄电池中Pb为负极,PbO2为正极H2SO4为电解质,以此写出电极反应;
(2)利用增大化学反应速率的知识回答酸溶过程中含铅废料需要粉碎;由反应方程![]() 可知每生成1mol PbSO4转移电子数为1mol;
可知每生成1mol PbSO4转移电子数为1mol;
(3)含铅废料中加入硫酸亚铁和稀硫酸溶解,生成硫酸铅为滤渣,滤液中含有过量的硫酸和硫酸亚铁;
(4)脱硫过程发生的是将硫酸铅转化为PbO,溶液为碱性,以此写出化学方程式;
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是:取最后一次洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次洗涤液滴入盐酸和氯化钡溶液,若不产生沉淀),说明已洗涤干净;
(6)由溶解度曲线图可知PbO在35%的NaOH溶液中溶解度随着温度的变化溶解度变化较大。
(1)铅蓄电池中Pb为负极,PbO2为正极H2SO4为电解质,电极反应为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)酸溶过程中含铅废料需要粉碎目的是增大固体表面积,提高反应速率;由反应方程![]() 可知每生成1mol PbSO4转移电子数为1mol,故答案为:增大固体表面积,提高反应速率;1mol;;
可知每生成1mol PbSO4转移电子数为1mol,故答案为:增大固体表面积,提高反应速率;1mol;;
(3)含铅废料中加入硫酸亚铁和稀硫酸溶解,生成硫酸铅为滤渣,滤液中含有过量的硫酸和硫酸亚铁,故主要阳离子为H+ 、Fe2+,故答案为:H+ 、Fe2+;
(4)脱硫过程发生的是将硫酸铅转化为PbO,主要反应的离子方程式为:![]() ,故答案为:PbSO4 +2OH-=PbO+SO4 2-+H 2O;
,故答案为:PbSO4 +2OH-=PbO+SO4 2-+H 2O;
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,检验沉淀是否洗涤干净的方法是:取最后一次洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次洗涤液滴入盐酸和氯化钡溶液,若不产生沉淀),说明已洗涤干净,故答案为:取最后一次洗涤液,做焰色反应实验,火焰不变黄色(或取最后一次洗涤液滴入盐酸和氯化钡溶液,若不产生沉淀),说明已洗涤干净;
(6)由溶解度曲线图可知PbO在35%的NaOH溶液中溶解度随着温度的变化溶解度变化较大,则将粗PbO 溶解在一定量35%的NaOH溶液中再通过加热至 110℃左右,充分溶解后,趁热过滤,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO,故答案为:35%;趁热过滤。