题目内容
标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
(1)n(HCl)=
=0.2mol,c(HCl)=
=2mol/L,
答:所得盐酸的物质的量浓度为2mol/L;
(2)Fe+2HCl=FeCl2+H2↑
2mol 22.4L
0.2mol V
V=2.24L,
答:生成H2的体积为2.24L;
(3)n(FeCl2)=0.1mol,
c(FeCl2)=
=0.25mol/L,
答:溶液中FeCl2的物质的量浓度是0.25 mol/L.
| 4.48L |
| 22.4L/mol |
| 0.2mol |
| 0.1L |
答:所得盐酸的物质的量浓度为2mol/L;
(2)Fe+2HCl=FeCl2+H2↑
2mol 22.4L
0.2mol V
V=2.24L,
答:生成H2的体积为2.24L;
(3)n(FeCl2)=0.1mol,
c(FeCl2)=
| 0.1mol |
| 0.4L |
答:溶液中FeCl2的物质的量浓度是0.25 mol/L.

练习册系列答案
相关题目
请按要求回答下列问题:
(1)新出土的青铜器若保存不善,在潮湿的环境中容易生成铜绿,该腐蚀过程中的负极反应式为:_________________________。
(2)惰性电极电解饱和Na2S溶液时,在阳极附近没有看到预期的浑浊现象,探究发现,其生成了Na2Sx,则阳极反应式为:_____________________。当阳极产生1mol Sx2-时,阴极产生的气体在标准状况下的体积为_________L。(用含x的代数式表示)
(3)合成氨工业中,天然气能代替煤用于生产原料气——H2,且反应类似。请写出天然气转化为H2的两步反应方程式:______________________________________,
___________________________________________。
(4)已知:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1 = 4.2×10-7 | HClO | 3×10-8 |
| Ka2 = 5.6×10-11 |
②25℃时,0.01 mol/L NaCN溶液的pH________7;
③在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
④25℃时,向20mL 0.1 mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图像正确的是_____________。
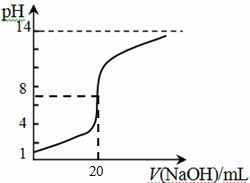

A B
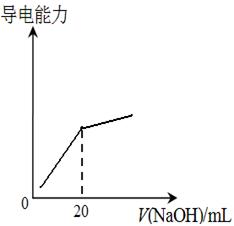
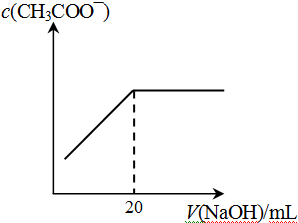
C D
 B.
B.
 D.
D.