题目内容
能源是现代社会发展的支柱之一,化学能是重要的能源.
(1)下列反应中,属于吸热反应的是______(填选项序号).a.Ba(OH)2?8H2O与NH4Cl混合搅拌 b.生石灰加入水中c.盐酸与NaOH溶液反应 d.H2在O2中燃烧
(2)某同学进行如右图所示实验,测量铝与盐酸反应中的能量变化.实验表明:反应温度升高,由此判断铝与盐酸反应是______(填“吸热”或“放热”)反应,其离子方程式是______,其中还原剂是______(填化学式).
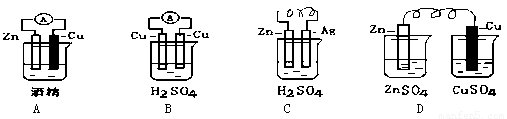
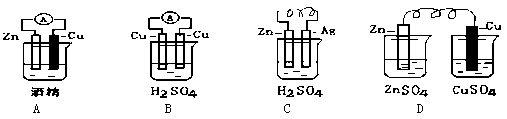
(3)电能是现代社会应用最广泛的能源之一.下图所示为锌、铜和稀硫酸组成的原电池,其负极是______,正极的电极反应式是______.若电路中有1mol电子转移,则在标准状况下产生H2的体积为______L.


(1)下列反应中,属于吸热反应的是______(填选项序号).a.Ba(OH)2?8H2O与NH4Cl混合搅拌 b.生石灰加入水中c.盐酸与NaOH溶液反应 d.H2在O2中燃烧
(2)某同学进行如右图所示实验,测量铝与盐酸反应中的能量变化.实验表明:反应温度升高,由此判断铝与盐酸反应是______(填“吸热”或“放热”)反应,其离子方程式是______,其中还原剂是______(填化学式).
(3)电能是现代社会应用最广泛的能源之一.下图所示为锌、铜和稀硫酸组成的原电池,其负极是______,正极的电极反应式是______.若电路中有1mol电子转移,则在标准状况下产生H2的体积为______L.


(1)a、Ba(OH)2?8H2O与NH4Cl混合搅拌后二者的反应为吸热反应,故a正确;
b、生石灰和水反应生成氢氧化钙的反应是放热反应,故b错误;
c、酸碱中和反应属于放热反应,故c错误;
d、物质的燃烧反应为放热反应,故d错误.
故选a;
(2)金属铝和酸的反应实质是2Al+6H+=2Al3++3H2↑,属于放热反应,,其中铝元素化合价升高,所以金属铝是还原剂,故答案为:放热;2Al+6H+=2Al3++3H2↑;Al;
(3)锌、铜和稀硫酸组成的原电池,其负极是较活泼的金属锌,正极是金属铜,正极的电极反应式是:2H++2e-=H2↑,若电路中有1mol电子转移,所以生成氢气的物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2L,
故答案为:Zn;2H++2e-=H2↑;11.2.
b、生石灰和水反应生成氢氧化钙的反应是放热反应,故b错误;
c、酸碱中和反应属于放热反应,故c错误;
d、物质的燃烧反应为放热反应,故d错误.
故选a;
(2)金属铝和酸的反应实质是2Al+6H+=2Al3++3H2↑,属于放热反应,,其中铝元素化合价升高,所以金属铝是还原剂,故答案为:放热;2Al+6H+=2Al3++3H2↑;Al;
(3)锌、铜和稀硫酸组成的原电池,其负极是较活泼的金属锌,正极是金属铜,正极的电极反应式是:2H++2e-=H2↑,若电路中有1mol电子转移,所以生成氢气的物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2L,
故答案为:Zn;2H++2e-=H2↑;11.2.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
能源是现代社会发展的三大支柱之一。化学在提高能源的利用率和开发新能源中起到了重要的作用。
(1)下列说法中,正确的是 。(填序号)
| A.煤、石油和天然气都是可再生的能源 |
| B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能 |
| C.人体运动所消耗的能量与化学反应无关 |
| D.人类目前所直接利用的能量大部分是由化学反应产生的 |
(3)锌锰干电池是目前使用最广泛的一种电池,其正极材料是石墨棒,它在放电时总反应式可表示为:Zn+ 2 MnO2 + 2 NH4+ ="=" Zn2+ + Mn2O3(S)+ 2NH3 + H2O。写出该电池负极反应的电极反应式 。当电极锌消耗6.5g时,可对外提供的电子是 mol。
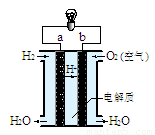
(4)右图是氢氧燃料电池构造示意图(电解质溶液为稀硫酸)。关于该电池的说法不正确的是
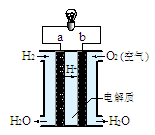
①.a极是负极
②.正极的电极反应是:O2+2H2O+4e-=4OH-
③.该装置可以将化学能完全转化为电能
④.氢氧燃料电池是环保电池
(5)人类在使用能源的过程中会产生环境问题。利用化学反应可以有效的进行治理。减少汽车等机动车尾气污染可在汽车尾气系统中增加催化转化装置,尾气中的CO、NO在催化剂的作用下反应生成两种参与大气循环的无毒气体,写出该反应的化学方程式 。
 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.
 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.