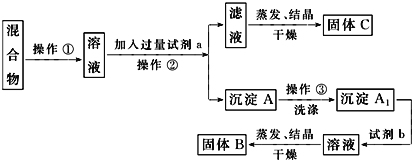
题目内容
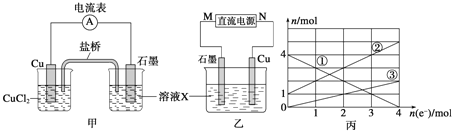
【题目】如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应 “AsO43-+2I-+2H+![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是( )
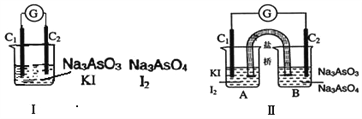
A. 甲组操作时,微安表(G)指针发生偏转
B. 甲组操作时,溶液颜色变浅
C. 乙组操作时,C2做正极
D. 乙组操作时,C1上发生的电极反应为I2+2e-=2I-
【答案】D
【解析】图Ⅰ烧杯中逐滴加入适量浓盐酸,AsO43-+2I-+2H+![]() AsO33-+I2+H2O平衡向正方向移动,溶液颜色加深,故B错误;但是氧化反应和还原反应在溶液中发生,不能形成原电池,故A错误;图Ⅱ,B烧杯中逐滴加入适量40%NaOH溶液,上述平衡向逆方向移动,氧化反应和还原反应在两极发生,形成原电池,其中C1上发生:I2+2e-=2I-,为原电池正极;C2上发生:AsO33――2e-+2OH-=AsO43―+H2O,为原电池负极,故C错误,D正确。
AsO33-+I2+H2O平衡向正方向移动,溶液颜色加深,故B错误;但是氧化反应和还原反应在溶液中发生,不能形成原电池,故A错误;图Ⅱ,B烧杯中逐滴加入适量40%NaOH溶液,上述平衡向逆方向移动,氧化反应和还原反应在两极发生,形成原电池,其中C1上发生:I2+2e-=2I-,为原电池正极;C2上发生:AsO33――2e-+2OH-=AsO43―+H2O,为原电池负极,故C错误,D正确。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目