题目内容
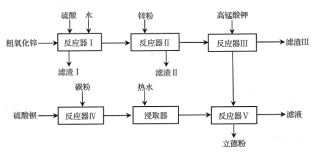
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废水(镍主要以NiR2络合物形式存在)制取草酸镍(NiC2O4),再高温灼烧草酸镍制取三氧化二镍。工艺流程如图所示:

已知:①NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
②Ksp[Fe(OH)3] =2.16×10-39, Ksp[Ni(OH)2] =2×10-15
③Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH.
ii.R-+·OH=OH-+·R
iii.H2O2+2OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是_______。
(2)“沉铁”时,若溶液中c(Ni2+)=0.01 mol/L,加入碳酸钠调溶液的pH为______(假设溶液体积不变,1g6≈0.8)使Fe 3+恰好沉淀完全(离子的浓度≤1.0×10-5 mol/L),此时_____(填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时pH=3的草酸溶液中 =____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
=____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
(4)加入Fe2+和H2O2能够实现“脱络”的原因是____________。
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为三氧化二镍。写出该反应的离子方程式:____________。
【答案】![]() 2.8 无 3.02 Ni2++H2C2O4=NiC2O4↓+2H+ Fe2+和H2O2发生反应产生·OH,·OH将R-转化为·R,c(R-)减小,使平衡NiR2(aq)
2.8 无 3.02 Ni2++H2C2O4=NiC2O4↓+2H+ Fe2+和H2O2发生反应产生·OH,·OH将R-转化为·R,c(R-)减小,使平衡NiR2(aq)![]() Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络” ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O
Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络” ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O
【解析】
Fe2+与H2O2反应产生中间产物OH、Fe3+、OH-,含镍废水NiR2在“脱络”过程中R-与中间产物OH反应产生R和OH-,然后向溶液中加入Na2CO3,发生盐的双水解反应产生Fe(OH)3沉淀和CO2气体,过滤后向滤液中价态草酸,发生反应产生NiC2O4沉淀,然后灼烧NiC2O4与O2反应产生Ni2O3、CO2气体。
(1)中间产物OH由氧原子与氢原子之间形成一对共用电子对,电子式为:![]() ;
;
(2)“沉铁”时,铁离子沉淀完全,根据Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.16×10-39,则c(OH-)=![]() mol/L=6×10-12 mol/L,故c(H+)=
mol/L=6×10-12 mol/L,故c(H+)= ×10-2 mol/L,所以此时pH=-lg c(H+)=2+lg6=2.8;溶液中c(Ni2+)=0.01 mol/L,则Qc[Ni(OH)2]=0.01 mol/L×(6×10-12 mol/L)2<Ksp[Ni(OH)2]=2×10-15,因此此时无Ni(OH)2沉淀生成;
×10-2 mol/L,所以此时pH=-lg c(H+)=2+lg6=2.8;溶液中c(Ni2+)=0.01 mol/L,则Qc[Ni(OH)2]=0.01 mol/L×(6×10-12 mol/L)2<Ksp[Ni(OH)2]=2×10-15,因此此时无Ni(OH)2沉淀生成;
(3)25℃时,pH=3的草酸溶液中 =3.02;“沉镍”即镍离子与草酸得到草酸镍沉淀,离子方程式为:Ni2++H2C2O4=NiC2O4↓+2H+;
=3.02;“沉镍”即镍离子与草酸得到草酸镍沉淀,离子方程式为:Ni2++H2C2O4=NiC2O4↓+2H+;
(4)加入Fe2+和H2O2能够实现“脱络”的原因是是Fe2+和H2O2发生反应生成OH,OH将R-转化为R,c(R-)减小,使平衡使平衡NiR2(aq)![]() Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络”;
Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络”;
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为Ni2O3,ClO-被还原产生Cl-。根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为:ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案