题目内容
7.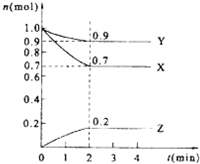 某温度时,在5L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
某温度时,在5L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.(1)生成物为Z;
(2)由图中所给数据进行分析,该反应的化学方程式为3X+Y?2Z;
(3)2min时X的浓度为0.14mol/L;
(4)反应从开始至2min末,用Y表示的反应速率为v(Y)=0.01 mol/(L•min);
(5)当反应进行了2min时,该反应是否达到平衡是(填“是”或“否”).
分析 (1)根据物质的量的变化判断反应物和生成物;
(2)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(3)根据2min末剩余的X的物质的量,利用浓度定义计算;
(4)根据v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$计算反应速率;
(5)根据平衡时各组分的物质的量不变这一特征作判断.
解答 解:(1)根据图象可知X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,故答案为:Z;
(2)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)2min末剩余的X的物质的量为0.7mol,浓度为$\frac{0.7mol}{5L}$=0.14mol/L,故答案为:0.14mol/L;
(4)反应开始至2 min时,Y的物质的量减少了1.0mol-0.9mol=0.1mol,所以反应速率V=$\frac{\frac{0.1mol}{5L}}{2min}$=0.01 mol/(L•min),故答案为:0.01 mol/(L•min);
(5)根据图象可知,当在2mim时,反应中各组份的物质的量不再随时间变化而变化,此时反应达到平衡状态,故答案为:是.
点评 本题主要考查了根据图象写化学方程式、化学反应速率计算、平衡状态的判断等知识,难度较小,注重对基础知识的考查.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
17.下列各组物质是按化合物、单质、混合物顺序排列的是( )
| A. | 烧碱、液态氧、碘酒 | B. | 生石灰、白磷、熟石灰 | ||
| C. | 干冰、铁、氯化氢 | D. | 纯碱、氮气、氧气 |
18.下列电离方程式正确的是( )
| A. | NaHCO3(溶液):NaHCO3═Na++H++CO32- | |
| B. | NaHSO4(溶液):NaHSO4═Na++H++SO42- | |
| C. | (NH4)2SO4(溶液):(NH4)2SO4═(NH4)2++SO42- | |
| D. | CuCl2(溶液):CuCl2═Cu2++Cl2- |
15.某化学反应的能量变化如图所示.下列有关叙述正确的是( )
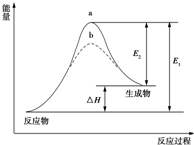

| A. | 该反应的反应热△H=E2-E1 | B. | 该反应为放热反应 | ||
| C. | 催化剂能改变反应的活化能 | D. | 催化剂能改变反应的焓变 |
2.下列各组物质中化学键类型完全相同的是( )
| A. | HCl、NaCl | B. | HCl、Na2O | C. | CaCl2、CO2 | D. | NH3、CO2 |
12.下列有关说法正确的是( )
| A. | 目前我国流通的硬币是由合金材料制成的 | |
| B. | Al与S直接化合可以得到Al2S3,则Fe与S直接化合也可以得到Fe2S3 | |
| C. | 黄铜耐腐蚀性强,不能与稀盐酸反应 | |
| D. | 某金(Au)合金的组成可表示为CuAu3.,其中金为-3价 |
19.下列说法中,错误的是( )
| A. | 利用聚光手电筒照射,可以区别溶液和胶体 | |
| B. | 溶液、胶体、悬浊液和乳浊液等分散系中的溶质均以分子形式存在 | |
| C. | 分散质粒子的直径在1×10-9~1×10-7m之间的分散系属于胶体 | |
| D. | 自来水厂常用某些铁盐或铝盐作净水剂 |
17.下列说法正确的是( )
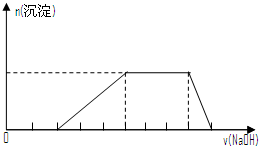

| A. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| B. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| C. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| D. | 某溶液中可能含有H+、Na+、NH${\;}_{4}^{+}$、Mg2+、Fe3+、Al3+、SO${\;}_{4}^{2-}$等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH${\;}_{4}^{+}$、Mg2+、Al3+ |
18.下列说法正确的是( )
| A. | 天然气、煤和石油都是清洁能源 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |