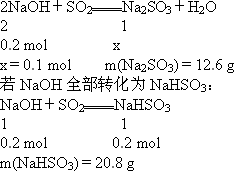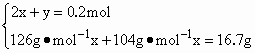题目内容
如果将一定体积的二氧化硫通入100 mL 2 mol·L-1的NaOH溶液中,使其完全反应,经测定溶液含16.7 g溶质,试分析该溶液中的成分,并计算各成分的物质的量.
答案:
解析:
解析:
|
答案:Na2SO3 0.05 mol,NaHSO3 0.10 mol 解析:解答本题一般采用极端假设法来确定反应产物的成分.n(NaOH)=0.2 mol 现溶液中含16.7 g溶质,介于12.6 g与20.8 g之间,故16.7 g溶质是Na2SO3和NaHSO3的混合物.设溶液中含Na2SO3的物质的量为x、NaHSO3的物质的量为y,根据溶液中Na守恒及溶质质量得 解得 故Na2SO3含0.05 mol,NaHSO3 0.10 mol |

练习册系列答案
相关题目
关于电解质溶液的说法正确的是
| A.中和等体积,等pH的盐酸和醋酸溶液,盐酸所需氧氧化钠小于醋酸 |
| B.强电解质溶液的导电能力一定比弱电质溶液强 |
| C.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减小到原来的一半 |
| D.如果盐酸的浓度是醋酸溶液的二倍,则盐酸的H+浓度也是醋酸H+浓度的二倍 |