题目内容
(2011?上海)过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
|
分析:由化学方程式:2Na2O2+2CO2═2Na2CO3+O2,根据质量差求出二氧化碳、碳酸钠的物质的量,进而求出碳酸钠的质量和转移的电子数.
解答:解:设二氧化碳和过氧化钠反应,当固体质量增加28g时,
参与反应二氧化碳的物质的量为x,生成碳酸钠的物质的量为y
2Na2O2+2CO2═2Na2CO3+O2 固体质量差
2mol 2mol 56g
x y 28g
=
解之得:x=1mol
=
解之得:y=1mol
碳酸钠的质量=1mol×106g/mol=106g
因常温常压下发生的反应,1mol二氧化碳的体积>22.4L;
由化学方程式可知;1mol二氧化碳参与反应转移1mol电子,即有 NA个电子转移.
由此可知上表中①③正确.
故选AC.
参与反应二氧化碳的物质的量为x,生成碳酸钠的物质的量为y
2Na2O2+2CO2═2Na2CO3+O2 固体质量差
2mol 2mol 56g
x y 28g
| 2mol |
| x |
| 56g |
| 28g |
| 2mol |
| y |
| 56g |
| 28g |
碳酸钠的质量=1mol×106g/mol=106g
因常温常压下发生的反应,1mol二氧化碳的体积>22.4L;
由化学方程式可知;1mol二氧化碳参与反应转移1mol电子,即有 NA个电子转移.
由此可知上表中①③正确.
故选AC.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算以及氧化还原反应中电子转移数目的计算,难度较小.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
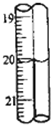 第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为
第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为