题目内容
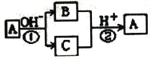
【题目】某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

A. 固体1中只含有CaCO3和CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:5NH4++3NO2-==4N2↑+6H2O+H+
【答案】C
【解析】工业废气中CO2、SO2可被石灰水吸收,生成固体1为CaCO3、CaSO3,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到硝酸钠,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,则气体2含有CO、N2,捕获剂所捕获的气体主要是CO。A.工业废气中CO2、SO2可被石灰水吸收,生成CaCO3、CaSO3,因氢氧化钙过量,则固体1为主要含有Ca(OH)2、CaCO3、CaSO3,故A错误;B.由分析可知,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到硝酸钠,故B错误;C.气体2含有CO、N2,经捕获剂得到氮气和CO,所捕获的气体主要是CO,防止污染空气,故C正确;D.NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,发生氧化还原反应,离子方程式为NH4++NO2-=N2↑+2H2O,故D错误;故选C。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】实验室制备1,2﹣二溴乙烷,用16.0g的溴和足量的乙醇制备1,2﹣二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:
有关数据列表:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/0C | 78.5 | 132 | 34.6 |
熔点/0C | ﹣130 | 9 | ﹣116 |
溶解性 | 易溶水 | 难溶水 | 微溶于水 |
请回答下列问题: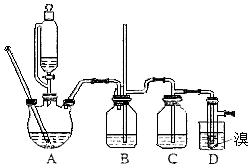
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是(填正确选项前的字母;
a、引发反应 b、加快反应速度 c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是 .
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是;
(6)反应过程中应用冷水冷却装置D,其主要目的是 , 但又不能过度冷却(如用冰水),其原因是;
(7)本实验中,1,2﹣二溴乙烷的产率为 .
【题目】实验室常用的分离操作有:①萃取分液法②结晶法③分液法④蒸馏法⑤过滤法。选择以上方法分离混合物,选择正确的是( )
A. | 饱和食盐水与沙子的混合物 | ①萃取分液法 |
B. | 水和汽油的混合物 | ④蒸馏法 |
C. | 从碘的水溶液里提取碘 | ③分液法 |
D. | 从硝酸钾和氯化钠的混合液中获得硝酸钾 | ②结晶法 |
A.A B.B C.C D.D