题目内容
3.“84消毒液”能有效杀灭甲型H,N.等病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”含25%NaClO、1000mL、密度1.192g•cm-3,稀释100倍(体积比)后使用.
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为4.0molL-l.
(2)该同学取100mL稀释后的消毒液用于消毒,稀释后溶液中c(Na+)=0.04mol•L-l.
(3)一瓶“威露士”牌“84消毒液”最多能吸收空气中CO289.6L(标准状况)而变质.
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25% NaClO的消毒液.下列说法正确的是C(填编号).
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
(5)最近发生多起“84消毒液”和洁厕灵混合使用的安全事故,请解释发生事故的原因是二者混合会发生反应生成有毒气体氯气而使人中毒.
分析 (1)该溶液的物质的量浓度=$\frac{1000ρω}{M}$;
(2)稀释100倍后,溶液中NaClO浓度应该是浓溶液的$\frac{1}{100}$,根据钠原子守恒计算稀释后钠离子浓度;
(3)根据次氯酸钠和二氧化碳反应方程式计算消耗二氧化碳体积;
(4)A.该实验中需要的仪器有托盘天平、玻璃棒、烧杯、容量瓶、胶头滴管;
B.容量瓶用蒸馏水洗净后,配制溶液时不需要烘干;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,根据m=cVM计算次氯酸钠质量;
(5)次氯酸钠和浓盐酸发生氧化还原反应生成氯气,氯气有毒.
解答 解:(1)该溶液的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.192×25%}{74.5}$mol/L=4.0mol/L,故答案为:4.0;
(2)稀释100倍后,溶液中NaClO浓度应该是浓溶液的$\frac{1}{100}$,为0.04mol/L,根据钠原子守恒得c(Na+)=c(NaClO)=0.04mol/L,故答案为:0.04;
(3)一瓶“84消毒液”含有n(NaClO)=1 L×4.0 mol•L-1=4.0 mol,
根据反应CO2+NaClO+H2O═NaHCO3+HClO,则需要CO2的物质的量为n(NaClO)=4.0 mol,
即标准状况下V(CO2)=4.0 mol×22.4 L•mol-1=89.6 L,
故答案为:89.6;
(4)A.该实验中需要的仪器有托盘天平、玻璃棒、烧杯、容量瓶、胶头滴管,所以还需要两种玻璃仪器,故A错误;
B.容量瓶用蒸馏水洗净后,配制溶液时不需要烘干,因为留有的少量水不影响溶液配制,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D、应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol•L-1×74.5 g•mol-1=149 g,故D错误;
故选C;
(5)洁厕灵的主要成分是浓盐酸,次氯酸钠和浓盐酸发生氧化还原反应生成氯气,氯气有毒,所以会产生中毒现象,故答案为:二者混合会发生反应生成有毒气体氯气而使人中毒.
点评 本题以氯元素及其化合物为载体考查溶液配制、氯气性质、物质的量及物质的量浓度计算等知识点,为高频考点,侧重考查学生分析判断及计算能力,注意:次氯酸钠和二氧化碳、水反应生成碳酸氢钠而不是碳酸钠,为易错点.

 阅读快车系列答案
阅读快车系列答案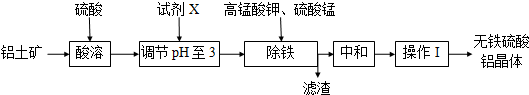
| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)操作I的名称蒸发浓缩、冷却结晶、过滤洗涤;
(4)除铁时,必须先加入高锰酸钾溶液,目的是把Fe2+转化为Fe3+;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)滤渣的含铁成分是Fe(OH)3,用离子方程式表示其成因Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).

已知:
①镧是较活泼金属,在空气中易被氧化;
②氢氧化镧是难溶于水的弱碱;
③
| 金 属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1 487 |
| 镧 | 920 | 3 470 |
(2)操作2要在HCl气体的氛围内加热的原因是防止LaCl3水解.
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)真空、高温过程中的反应方程式为3Ca+2LaF3$\frac{\underline{\;真空\;}}{高温}$3CaF2+2La.
(5)粗镧精制过程中温度控制范围1487~3470℃.
(6)重熔蒸馏制得的镧中仍然混有极少量的钙.某批次产品69.709g,经分析含钙0.209g,该产品的等级为分析纯(化工产品等级标准:优级纯≥99.8%,分析纯≥99.7%,化学纯≥99.5%)
| A. | 硅胶可用作袋装食品干燥剂 | |
| B. | 纯净的SiO2可以制备光导纤维 | |
| C. | 硅酸盐一般易溶于水,化学性质很稳定 | |
| D. | 晶体硅是良好的半导体材料,可用于制造计算机芯片 |
| A. | H2、NaOH | B. | H2、Al(OH)3 | C. | H2、NaCl、NaAlO2 | D. | H2、NaCl、Al(OH)3 |
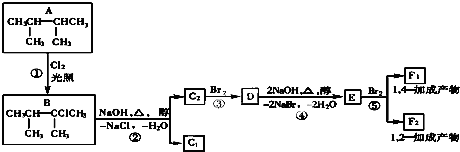
 .
. ,F1的结构简式是
,F1的结构简式是 .
.
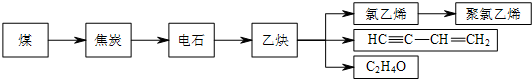
 ,随意丢弃聚氯乙烯制品会造成白色污染.
,随意丢弃聚氯乙烯制品会造成白色污染.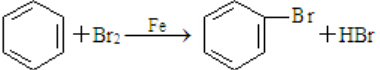 ,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).
,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).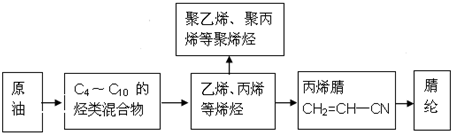
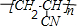 .
.