题目内容
【题目】已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.升高温度能使![]() 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075mol·L-1·min-1
【答案】B
【解析】
A. CO2(g)+3H2(g) CH3OH(g)+H2O(g)正反应放热,升高温度,平衡逆向移动,升高温度能使![]() 减小,故A错误;
减小,故A错误;
B. 反应达到平衡状态时,CO2的平衡转化率为![]() 75%,故B正确;
75%,故B正确;
C. 3min时,反应没有达到平衡状态,用CO2的浓度表示的正反应速率不等于用CH3OH的浓度表示的逆反应速率,故C错误;
D. 从反应开始到平衡,H2的浓度变化为0. 75mol·L-1×3=2.25 mol·L-1,平均反应速率![]() (H2)=2.25 mol·L-1÷10min=0.225mol·L-1·min-1,故D错误;
(H2)=2.25 mol·L-1÷10min=0.225mol·L-1·min-1,故D错误;
选B。

【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
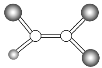
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D