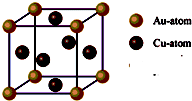
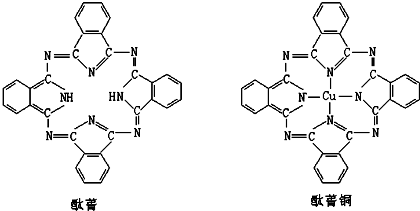
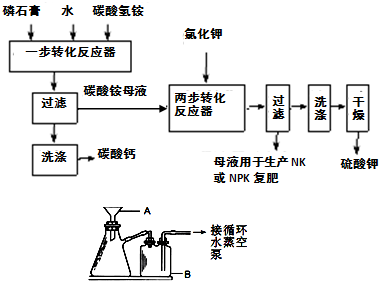
��Ŀ����
��10�֣���������������Ҫ�Ľ��������ǵĵ��ʼ����������Ÿ��Ե����ʡ�
(1)��һ���¶��£�������������һ����̼�������з�Ӧ��
Fe2O3��s����3CO��g�� 2Fe��s����3CO2��g����H��0
2Fe��s����3CO2��g����H��0
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ��K=
�ڸ��¶��£���2Lʢ�� ��ĩ���ܱ�������ͨ��CO���壬10min�������˵�����11.2g����10min��CO��ƽ����Ӧ����Ϊ
��ĩ���ܱ�������ͨ��CO���壬10min�������˵�����11.2g����10min��CO��ƽ����Ӧ����Ϊ
(2)ijЩ�����������ĩ��Al����þ������ȼ�¿��Է������ȷ�Ӧ�����з�Ӧ����(v)���¶�(T)�Ĺ�ϵʾ��ͼ�������ȷ�Ӧ��ӽ����� ��

(3)Fe3+�κ�Al3+�����������кܶ����Ƶĵط���������������ܵĽ�״�����������ھ�ˮ��Ҳ�в�֮ͬ������Fe3+�������������л�ԭ�ԣ�Al3+ֻ�������ԡ���Fe3+ֻ���ڼ��Խ����в��ܱ�����ΪFeO42-����������з���ʽ��
Fe(OH)3 + ClO- + == FeO42- + Cl- + ;
(4)����ag Fe��Al�Ļ��������2mol/L�������������У�������Һ�м���������6mol/L��NaOH��Һ����ַ�Ӧ�����ˣ�ϴ�ӣ��������գ��������ù����������Ϊag����ԭ�������Al����������Ϊ
��1����c3(CO2)/c3(CO) ; ��0.015mol��L-1��min-1
��2��b
��3�� 2Fe(OH)3 + 3ClO- + 4OH- == 2 FeO42- + 3 Cl- + 5 H2O ;
��4��30%
��������
�����������1����ƽ�ⳣ��Ϊ�������Ũ����֮�����Է�Ӧ���Ũ����֮��������������������Ϊ���壬���Բ�������㡣���ȸ��ݻ�ѧ����ʽ��������ĵ�CO�����ʵ�����Ȼ�����V=��C/��t =��n/ (V ����t )���������ݼ��㣬��������CO�Ļ�ѧ��Ӧ���ʣ���2������ͨ�������������ȷ�Ӧ�Լ����ȷ�ӦΪ���ȷ�Ӧ�Լ��¶�����ѧ��Ӧ���ʼӿ죻��3������Ŀ��֪����Ҫ���Ի���������ӷ�Ӧ������������ӣ�����Ԫ���غ㣬�������ˮ�����������ݵ��ӵ�ʧ�غ㣬����غ�����ƽ����4����һ�������������������ƣ��������������ܽ⣬���ij���Ӧ�������������������������պ�ʣ�����������������������������Ϊ��������������������=��3��16��/��3��16+56��2����100%=30%
���㣺��ѧƽ�ⳣ���ļ��㣬��Ӧ���ʵļ��㣬������ԭ��Ӧ����ƽ�����������ļ���
�����������Կ�������������Ϊ�������漰�˺ܶ�Ļ�ѧ���㣬���ǻ����Ͽ��Ը��ݹ�ʽ�����㡣���ڼ��⡣

 �Ķ��쳵ϵ�д�
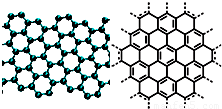
�Ķ��쳵ϵ�д�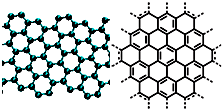 A����������ѧ����־������2009��ʮ���ѧͻ��֮һ��ʯīϩ���о���Ӧ�÷����ͻ�ƣ�ʯīϩ����ԭ�Ӽ��ĺ�ȡ�����ĵ�ѧ���ܡ���ɫ�Ļ�ѧ�ȶ��Ժ�����ѧ�ȶ��ԣ��Ʊ�ʯīϩ������ʯī���뷨����ѧ����������ȣ�ʯīϩ�����ģ�ͼ����ӽṹʾ��ͼ���ң�
A����������ѧ����־������2009��ʮ���ѧͻ��֮һ��ʯīϩ���о���Ӧ�÷����ͻ�ƣ�ʯīϩ����ԭ�Ӽ��ĺ�ȡ�����ĵ�ѧ���ܡ���ɫ�Ļ�ѧ�ȶ��Ժ�����ѧ�ȶ��ԣ��Ʊ�ʯīϩ������ʯī���뷨����ѧ����������ȣ�ʯīϩ�����ģ�ͼ����ӽṹʾ��ͼ���ң�