题目内容
|
下列各组离子,能在溶液中大量共存的是 | |
| [ ] | |
A. |
Ag+、K+、I-、 |
B. |
Cu2+、H+、Br-、S2- |
C. |
Mg2+、H+、Cl-、 |
D. |
K+、H+、S2-、 |
答案:C
提示:
提示:
|
解这类题的思路是:不同的离子是否能在溶液中大量共存,主要从以下几个方面考虑:①离子相互结合成难溶(微溶)物质或气体;②离子相互结合成弱电解质;③离子间发生氧化还原反应;④离子发生水解反应等均不能共存. A项中,Ag+与I-结合成AgI沉淀,所以不能共存. B项中,Cu2+与S2-结合成CuS沉淀,所以也不能共存. C项中的4种离子均能共存. D项中,H+和S2-可以结合成弱电解质,所以也不能共存. |

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
 。
。 ,Na+,HSO
,Na+,HSO ,PO
,PO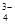 ,MnO
,MnO
 ,NO
,NO ,SO
,SO
 ,CO
,CO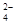 ,Cl
,Cl =0.1 mol/L的溶液中:Na+,K+,SO
=0.1 mol/L的溶液中:Na+,K+,SO 。
。