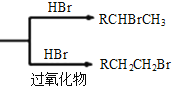
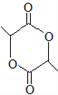
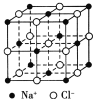
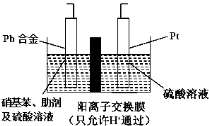
题目内容
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸的原料。氨经一系列反应可以得到硝酸,如图所示:
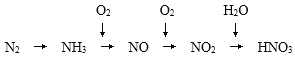
根据已知信息及所学知识回答下列问题:
(1)写出实验室制取氨气的化学方程式_____________;
(2)写出氨的催化氧化的化学方程式_____________;
(3)计算生成1.0mol HNO3需要_______molNH3。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 4NH3 + 5O2
CaCl2+2H2O+2NH3↑ 4NH3 + 5O2 ![]() 4NO + 6H2O 1.5
4NO + 6H2O 1.5
【解析】
(1)实验室通过加热氯化铵和氢氧化钙的固体混合物制取氨气;(2)氨在催化剂作用下被氧化生成一氧化氮和水;(3)根据4NH3 + 5O2 ![]() 4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO计算1.0mol HNO3需要的NH3。据此分析解答。
4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO计算1.0mol HNO3需要的NH3。据此分析解答。
(1)实验室通过加热氯化铵和氢氧化钙的固体混合物制取氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(2)氨在催化剂作用下被氧化生成一氧化氮和水,反应的化学方程式为4NH3 + 5O2 ![]() 4NO + 6H2O,故答案为:4NH3 + 5O2
4NO + 6H2O,故答案为:4NH3 + 5O2 ![]() 4NO + 6H2O;
4NO + 6H2O;
(3)根据4NH3 + 5O2 ![]() 4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO可得3NH3~3NO ~3NO2~2HNO3,因此生成1.0mol HNO3需要1.5molNH3,故答案为:1.5。
4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO可得3NH3~3NO ~3NO2~2HNO3,因此生成1.0mol HNO3需要1.5molNH3,故答案为:1.5。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④