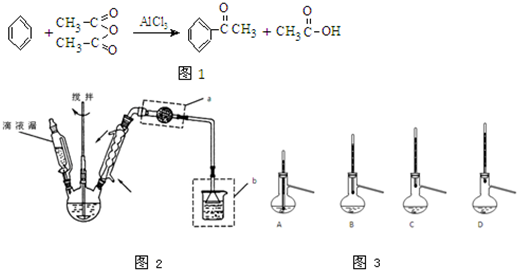
题目内容
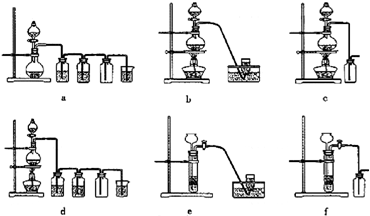
如图是实验室中制备气体或验证气体性质的装置图.(1)仪器a的名称是______.
(2)利用上图装置制备纯净、干燥的氯气.
①圆底烧瓶内发生反应的离子方程式为______ Mn2++Cl2↑+2H2O

【答案】分析:(1)依据装置图分析仪器a为分液漏斗;
(2)①依据实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
②依据氯气含有氯化氢和水蒸气分析装置B的作用,氯气是有毒气体不能排放到空气中;
(3)①证明SO2具有漂白性的装置是B装置中品红褪色
②证明SO2具有还原性的现象是C装置中 的高锰酸钾溶液褪色;
③证明生成气体中含有CO2的现象是E中澄清石灰水变浑浊,但防止二氧化硫气体的干扰;
④D装置是检验二氧化硫是否除净,防止干扰检验二氧化碳;
解答:解:(1)装置中a是想烧瓶中加入浓盐酸的仪器为分液漏斗;
故答案为:分液漏斗;
(2)①制备氯气是利用装置加热生成,试剂是二氧化锰和浓盐酸加热反应生成,反应的离子方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②氯气中含有氯化氢气体和水蒸气,氯化氢也可以被高锰酸钾溶液氧化,需要除去,避免干扰二氧化硫的检验,氯气有毒污染空气不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:饱和NaCl溶液; 吸收氯气防污染;
(3)①证明SO2具有漂白性的装置是B,装置中品红褪色说明生成二氧化硫气体;
故答案为:B;品红褪色;
②证明SO2具有还原性的现象是C装置中的高锰酸钾溶液褪色,还原高锰酸钾溶液表现还原性;
故答案为:C中KMnO4溶液褪色;
③证明生成气体中含有CO2的现象是装置D中 的品红不退色,证明二氧化硫除净,E中石灰水变浑浊证明生成二氧化碳气体;
故答案为:D中品红不褪色且石灰水变浑浊;
④D是检验二氧化硫通过C是否除净的作用;
故答案为:检验SO2是否除尽;
点评:本题考查实验室制备氯气的反应原理和装置分析,脏我基本操作和物质性质是解题关键,题目难度中等.
(2)①依据实验室制备氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
②依据氯气含有氯化氢和水蒸气分析装置B的作用,氯气是有毒气体不能排放到空气中;
(3)①证明SO2具有漂白性的装置是B装置中品红褪色
②证明SO2具有还原性的现象是C装置中 的高锰酸钾溶液褪色;
③证明生成气体中含有CO2的现象是E中澄清石灰水变浑浊,但防止二氧化硫气体的干扰;
④D装置是检验二氧化硫是否除净,防止干扰检验二氧化碳;
解答:解:(1)装置中a是想烧瓶中加入浓盐酸的仪器为分液漏斗;
故答案为:分液漏斗;
(2)①制备氯气是利用装置加热生成,试剂是二氧化锰和浓盐酸加热反应生成,反应的离子方程式为:MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;②氯气中含有氯化氢气体和水蒸气,氯化氢也可以被高锰酸钾溶液氧化,需要除去,避免干扰二氧化硫的检验,氯气有毒污染空气不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:饱和NaCl溶液; 吸收氯气防污染;
(3)①证明SO2具有漂白性的装置是B,装置中品红褪色说明生成二氧化硫气体;
故答案为:B;品红褪色;
②证明SO2具有还原性的现象是C装置中的高锰酸钾溶液褪色,还原高锰酸钾溶液表现还原性;
故答案为:C中KMnO4溶液褪色;
③证明生成气体中含有CO2的现象是装置D中 的品红不退色,证明二氧化硫除净,E中石灰水变浑浊证明生成二氧化碳气体;
故答案为:D中品红不褪色且石灰水变浑浊;
④D是检验二氧化硫通过C是否除净的作用;
故答案为:检验SO2是否除尽;
点评:本题考查实验室制备氯气的反应原理和装置分析,脏我基本操作和物质性质是解题关键,题目难度中等.

练习册系列答案
相关题目