题目内容
目前,科学家正在研究开发一种高能电池--钠硫电池,它以熔融钠、硫为两极,以导电的β-Al2O3陶瓷作固体电解质,反应式如下:2Na+xS?Na2Sx,以下说法正确的是( )A.放电时,Na作正极,S极发生还原反应
B.充电时,钠极与外电源的正极相连
C.放电时,阳极发生的反应为:S
 -2e=xS
-2e=xSD.若用此电池电解AgNO3溶液,当阳极产生标准状况下的气体1.12L时,消耗的金属钠为4.6g
【答案】分析:在放电时,原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-;原电池负极发生失电子的氧化反应,在反应2Na+xS=Na2Sx中钠失电子,故负极反应为2Na-2e-=2Na+,在充电时,电解池的阳极发生的电极反应极为正极上的逆反应,阴极反应和负极互为逆反应.
解答:解:A、在放电时,硫单质得电子,作正极,钠失电子,作负极,故A错误;
B、充电时,钠极与外电源的负极相连,硫极与外电源的正极相连,故B错误;
C、放电时,是原电池反应,正极反应为:xS+2e-=Sx2-;故C错误;
D、电解AgNO3溶液时,阳极产生的1.12L(标况)气体,阳极0.05mol气体是氧气,即4OH--4e-=O2↑+2H2O,生成0.05mol氧气转移电子为0.2mol,根据钠硫电池放电时的负极反应:2Na-2e-=2Na+,则会消耗金属钠0.2mol,即4.6g,故D正确;
故选D.
点评:本题考查了二次电池的工作原理以及电极反应式的书写知识,放电和充电过程的实质判断,依据电子守恒进行电极产物的计算,可以根据教材知识来回答,难度不大.
解答:解:A、在放电时,硫单质得电子,作正极,钠失电子,作负极,故A错误;
B、充电时,钠极与外电源的负极相连,硫极与外电源的正极相连,故B错误;
C、放电时,是原电池反应,正极反应为:xS+2e-=Sx2-;故C错误;
D、电解AgNO3溶液时,阳极产生的1.12L(标况)气体,阳极0.05mol气体是氧气,即4OH--4e-=O2↑+2H2O,生成0.05mol氧气转移电子为0.2mol,根据钠硫电池放电时的负极反应:2Na-2e-=2Na+,则会消耗金属钠0.2mol,即4.6g,故D正确;
故选D.
点评:本题考查了二次电池的工作原理以及电极反应式的书写知识,放电和充电过程的实质判断,依据电子守恒进行电极产物的计算,可以根据教材知识来回答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
工厂烟道气中SO2直接排放到空气中会形成酸雨污染环境.利用海水脱硫是一种有效的方法,其工艺流程见图1:
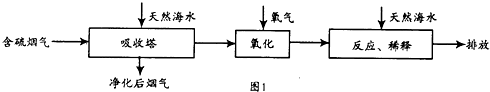
(1)常温下,无污染天然海水pH约为8,呈 性.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式为 .
(3)为研究脱硫率与温度、含硫烟气SO2浓度的关系,实验结果如下:
则T= .由表中实验数据可得出的结论是 .
(4)为测定某工厂烟道气中SO2的含量,使16.00L烟道气缓慢通过1.00L水,设SO2完全被吸收,且溶液体积不变.取出20.00mL溶液,加入2~3滴淀粉溶液后,用1.18×10-3mol?L-1的饱和碘水(密度为1g?cm-3)滴定,消耗19.07mL时溶液出现蓝色,则该厂烟道气中SO2的含量为 mg?L-1.
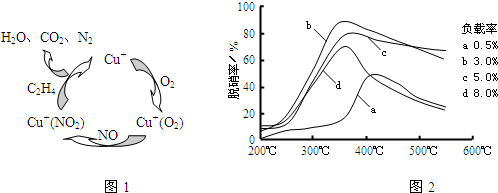
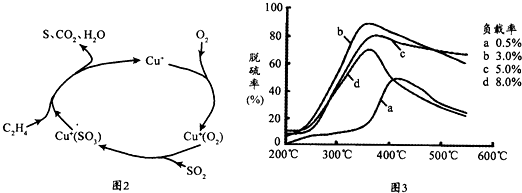
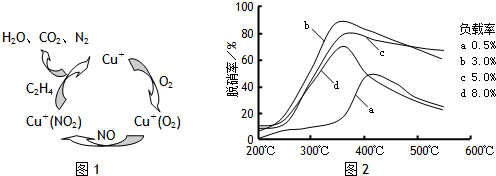
(5)目前,科学家正在研究一种以乙烯作为还原剂的脱硫(SO2)方法,其脱硫机理如图2,脱硫率与温度、负载率(分子筛中催化剂的质量分数)的关系如图3.
①该脱硫源理总反应的化学方程式为 .
②为达到最佳脱硫效果,应采取的反应条件是 .

(1)常温下,无污染天然海水pH约为8,呈
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式为
(3)为研究脱硫率与温度、含硫烟气SO2浓度的关系,实验结果如下:
| 实验序号 | 温度(K) | 含硫烟气SO2浓度(10-6mol.l-1) | 脱硫率(%) |
| Ⅰ | 298 | 400 | 99.5 |
| Ⅱ | T | 500 | 97.1 |
| Ⅲ | 313 | 400 | 94.3 |
(4)为测定某工厂烟道气中SO2的含量,使16.00L烟道气缓慢通过1.00L水,设SO2完全被吸收,且溶液体积不变.取出20.00mL溶液,加入2~3滴淀粉溶液后,用1.18×10-3mol?L-1的饱和碘水(密度为1g?cm-3)滴定,消耗19.07mL时溶液出现蓝色,则该厂烟道气中SO2的含量为
(5)目前,科学家正在研究一种以乙烯作为还原剂的脱硫(SO2)方法,其脱硫机理如图2,脱硫率与温度、负载率(分子筛中催化剂的质量分数)的关系如图3.
①该脱硫源理总反应的化学方程式为
②为达到最佳脱硫效果,应采取的反应条件是

 Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是
Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是