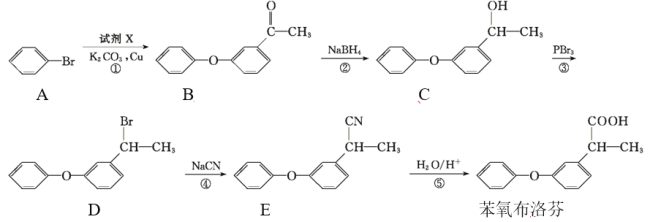
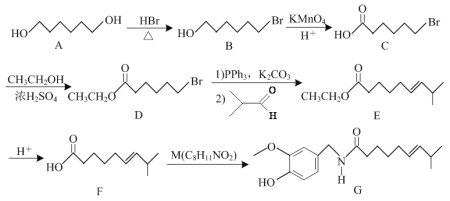
题目内容
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________(用百分数表示)
【答案】CaC2+2H2O―→Ca(OH)2+HC≡CH↑ 减慢反应速率 除H2S等气体 紫色溶液褪色 64b/26a×100%
【解析】
电石(碳化钙CaC2)与水反应生成乙炔和氢氧化钙,为减慢反应速率,可以用饱和食盐水代替蒸馏水;所得乙炔气体中含有杂质气体硫化氢,可以用硫酸铜溶液除去;高锰酸钾溶液能够氧化乙炔,本身褪色;乙炔能够与溴发生加成反应,根据溴的四氯化碳溶液增加的质量可以计算出乙炔的物质的量,根据CaC2+2H2O―→Ca(OH)2+HC≡CH↑反应计算出纯的碳化钙的量和质量,进而计算出电石的纯度。
(1)电石(碳化钙CaC2)与水反应生成乙炔和氢氧化钙,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
故答案是:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(2)制备乙炔需要消耗H2O,会使饱和食盐水中的NaCl析出,覆盖在电石表面,减小电石与H2O的接触,减慢反应速率;所以用饱和食盐水代替蒸馏水的目的是减慢反应速率;
故答案是:减慢反应速率;
(3)电石(碳化钙CaC2)与水反应生成乙炔的过程中,会有杂质气体硫化氢等产生,装置A的作用是除H2S等气体;乙炔属于不饱和烃,含有碳碳三键,能够与酸性高锰酸钾溶液发生氧化还原反应,乙炔被氧化,紫色高锰酸钾溶液被还原为无色溶液,故装置B中的现象是紫色溶液褪色;
故答案是:除H2S等气体;紫色溶液褪色;
(4)溴的CCl4溶液中溶液增重b g为乙炔气体的质量,所以n(C2H2)==b/26mol;根据CaC2+2H2O→Ca(OH)2+HC≡CH↑可知,n(CaC2)= n(C2H2)= b/26mol,m(CaC2)=64g/mol×b/26mol= 64b/26a×100%;
故答案是:64b/26a×100%。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na