题目内容
(5分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:
(1)参加反应Cu的质量为多少?
(2)被还原的硫酸的物质的量为多少 ?
(3)如果用98%浓硫酸(密度为1.84g·mL-1),则浓硫酸的体积至少多少mL?(保留小数点后一位)
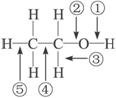
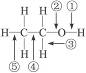
(5分)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O书写出方程式得1分
(1) 6.4g(1分)(2) n(H2SO4)=0.1mol(1分)(3) V(H2SO4)=10.9mL(2分)
解析:

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.
某化学兴趣小组,通过右图装置进行硫酸与铜反应的实验探究.(1)提出假设:
假设一:加热时,稀H2SO4与Cu能反应.
假设二:加热时,浓H2SO4与Cu能反应.
(2)设计实验:
| 实验编号 | 实验操作 | 实验现象 |
| 1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
| 2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
(3)实验结论:通过以上实验,说明浓硫酸具有
A.强氧化性 B.脱水性 C.吸水性
(4)问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液.该溶液中Cu2+物质的量浓度为
 填空题
填空题