题目内容
【题目】某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。查阅资料:SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,极易水解,遇潮湿空气会产生白雾。
(1)化合物SO2Cl2中S元素的化合价是__________。
(2)实验室中制备氯气时为得到干燥纯净的氯气,应将气体依次通过盛有_______和_______的洗气瓶。
(3)用如图所示装置制备SO2Cl2。
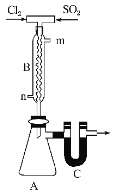
①B中冷凝水从__________ (填“m”或“n”)口进入。
②C中的药品是______。目的一是:_______________,目的二是:_______________。
③向A所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,写出SO2Cl2与H2O反应的化学方程式:_______________。
【答案】+6 饱和食盐水 浓硫酸 n 碱石灰 处理尾气氯气和二氧化硫 防止空气中的水进入A装置干扰实验 SO2Cl2+2H2O=H2SO4+2HCl
【解析】
(1)根据化合价的代数和为零计算;
(2)实验室中制备氯气时,因浓盐酸具有挥发性,氯气中混有挥发出的氯化氢和水蒸气;
(3)①为增强冷凝效果,应从冷凝管的下口n通入冷凝水;
②氯气和二氧化硫有毒,SO2Cl2极易水解,遇潮湿空气会产生白雾,则C中的药品应是碱石灰;
③由题意可知SO2Cl2与水反应生成硫酸和氯化氢。
(1)由题意SO2能被Cl2氧化生成SO2Cl2,则SO2Cl2分子中氧元素为-2价、氯元素为-1价,根据化合价的代数和为零可知硫元素的化合价为+6价,故答案为:+6;
(2)实验室中制备氯气时,因浓盐酸具有挥发性,氯气中混有挥发出的氯化氢和水蒸气,将制得的气体依次通过盛有饱和食盐水和浓硫酸的洗气瓶除去氯化氢和水蒸气得到干燥纯净的氯气,故答案为:饱和食盐水;浓硫酸;
(3)①SO2Cl2的沸点低,受热易挥发,则图中冷凝管的作用是冷凝回流制得的SO2Cl2,为增强冷凝效果,应从冷凝管的下口n通入冷凝水,故答案为:n;
②氯气和二氧化硫有毒,SO2Cl2极易水解,遇潮湿空气会产生白雾,则C中的药品应是碱石灰,一是吸收未反应的有毒的氯气和二氧化硫,防止污染环境,二是吸收空气中的水蒸气,防止空气中的水蒸气进入A装置中干扰实验,故答案为:处理尾气氯气和二氧化硫;防止空气中的水进入A装置干扰实验;
③由题意可知SO2Cl2与水反应生成硫酸和氯化氢,反应的化学方程式为化SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl。







