题目内容
4.下列关于晶体的说法一定正确的是( )| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | CaTiO3晶体(如图)中每个Ti4+和12个O2-相紧邻CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) | |
| C. | 金属晶体中金属离子电荷数越多,离子半径越小,金属键就越弱 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
分析 A、金属晶体中有金属阳离子和自由电子,无阴离子;
B、以顶点Ti4+离子研究,与之最近的O2-位于面心上,每个Ti4+离子为12个面共用;
C、金属晶体中金属离子电荷数越多,离子半径越小,金属键就越强;
D、金属晶体的熔点不一定高.
解答 解:A、金属晶体中有金属阳离子和自由电子,无阴离子,故A错误;
B、以顶点Ti4+离子研究,与之最近的O2-位于面心上,每个Ti4+离子为12个面共用,故每个Ti4+和12个O2-相紧邻,故B正确;
C、金属晶体中金属离子电荷数越多,离子半径越小,金属键就越强,故C错误;
D、金属晶体的熔点不一定比分子晶体的熔点高,W的熔点较低,故D错误;
故选B.
点评 本题考查晶体结构与性质,涉及化学键、熔点比较、晶胞结构等,难度中等,注意识记中学常见的晶胞结构.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
20.下列有关胶体的说法中,正确的是( )
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液体 | |
| B. | 胶粒能通过半透膜,所以可用渗析法提纯胶 | |
| C. | 光线透过胶体时,胶体中可发生丁达尔效应 | |
| D. | Fe(OH)3胶体在电场中可作定向移动,是因为Fe(OH)3胶体带电 |
19.下列卤代烃在NaOH醇溶液中加热不发生消去反应的是( )
①
②
③(CH3)3CCH2Cl
④
⑤
⑥CH3Cl.
①

②

③(CH3)3CCH2Cl
④

⑤

⑥CH3Cl.
| A. | ①③⑥ | B. | ②③⑤ | C. | 全部 | D. | ②④ |
16.下列实验操作不能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 除去淀粉溶液中的NaCl | 将混合物装入半透袋中,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有的A1粉 | 加足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗正口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关化学用语正确的是( )
| A. | HCl的电子式为: | B. | Cl-的结构示意图为: | ||
| C. | CO2的电子式: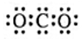 | D. | 乙烯的结构简式是CH2CH2 |