题目内容
17.下列溶液中,Cl-的物质的量浓度与50mL 1mol/L FeCl3溶液中Cl-物质的量浓度相等是( )| A. | 200 mL 2mol/LNaCl溶液 | B. | 75mL 1 mol/L MgCl2溶液 | ||
| C. | 150 mL 3mol/LKCl溶液 | D. | 25 mL 2 mol/L AlCl3溶液 |
分析 1mol/L FeCl3溶液中Cl-物质的量浓度为1mol/L×3=3mol/L,结合物质的构成及溶质浓度计算离子浓度,以此来解答.
解答 解:A.2mol/LNaCl溶液中Cl-物质的量浓度为2mol/L,故A不选;
B.1 mol/L MgCl2溶液中Cl-物质的量浓度为1mol/L×2=2mol/L,故B不选;
C.3mol/LKCl溶液中Cl-物质的量浓度为3mol/L,故C选;
D.2 mol/L AlCl3溶液中Cl-物质的量浓度为2mol/L×3=6mol/L,故D不选;
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握离子浓度与溶质浓度的关系为解答的关键,侧重分析与计算能力的考查,注意溶质的构成,题目难度不大.

练习册系列答案
相关题目
12.银器的保护主要是维持它的原貌,对于轻微腐蚀蒙有硫化银的银器,可将其和铝片一起接触浸泡在稀NaOH溶液中,经一定时间污迹消失,取出后用水洗于净,再用软布或棉团擦光.有关叙述正确的是( )
| A. | 溶液中的OH-离子向正极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 反应后容易的pH增大 | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
13.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 煤的干馏可得煤油、石蜡和沥青 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 干燥剂硅胶和硅橡胶的主要成分都是二氧化硅 | |
| D. | 二氧化硫有漂白性,常用作棉、麻和食品的漂白 |
5.A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.则下列说法正确的是( )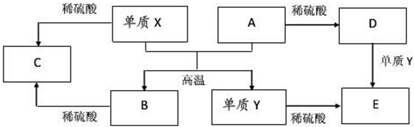

| A. | 单质X与A反应的化学方程式:Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| B. | 检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 单质X和单质Y在一定条件下均能与水发生置换反应 | |
| D. | 由于化合物B和C均既能与酸反应,又能与碱反应,所以两者均是两性氧化物 |
12.下列有关化学用语的表示正确的是( )
| A. | Ne和Na+的结构示意图均为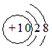 | |
| B. | NaHCO3在水中的电离方程式为NaHCO3=Na++HCO3- | |
| C. | 聚氯乙烯的结构简式为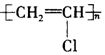 | |
| D. | MgCl2的电子式为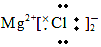 |
2.下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是( )
| A. | 2AB(g)?A2(g)+B2(g)△H>0 | B. | A2(g)+3B2(g)?2AB3(g)△H<0 | ||
| C. | A(s)+B(g)?C(g)+D(g)△H>0 | D. | 2A(g)+B(g)?3C(g)+D(s)△H<0 |
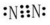 .
.