题目内容
氰化物有剧毒,在碱性条件下可用如下方法进行处理:
2CN-+120H-+5Cl2=2CO32-+N2+10Cl-+6H20,则下列判断中,不正确的是
A.上述反应中的氧化剂是Cl2
B.该反应过程中只有氮元素被氧化
C.还原性:CN-> Cl-
D.当有1 molCl2参加反应时,转移的电子数为2mol
【答案】
B
【解析】
试题分析:正确判断反应中变价元素的化合价,理清氧化还原反应的基本概念和基本规律是解题的关键。A、由题给反应知,氯元素的化合价由0价降低到-1价,得到电子作氧化剂,正确;B、该反应中,CN-中的碳元素的化合价由+2价升高到+4价,氮元素的化合价由-3价升高到0价,这两种元素均被氧化 ,错误;C、该反应中的还原剂是CN-,还原产物是Cl-,所以还原性CN->Cl-,正确; D、由题给反应知,氯元素的化合价由0价降低到-1价,当有1 molCl2参加反应时,转移的电子数为2mol,正确。
考点:考查氧化还原反应的基本概念和基本规律及电子转移。

练习册系列答案
相关题目
氰化物有剧毒,在碱性条件下可用如下方法进行处理:2CN-+80H-+5Cl2=2C02+N2+1OCl-+4H20o 下列判断错误的是( )
| A、上述反应中的氧化剂是Cl2 | B、还原性:CN->Cl- | C、当有O.2 mol CO2生成时,溶液中阴离子的物质的量增加1mol | D、经测定NaCN的水溶液呈碱性,说明CN^促进了水的电离 |
氰化物有剧毒,在碱性条件下可用如下方法进行处理: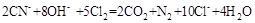 。下列判断错误的是
。下列判断错误的是
A.上述反应中的氧化剂是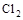 |
B.还原性: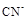 > >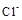 |
C.当有0.2 生成时,溶液中阴离子的物质的量增加1 生成时,溶液中阴离子的物质的量增加1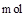 |
D.经测定 的水溶液呈碱性,说明 的水溶液呈碱性,说明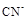 促进了水的电离 促进了水的电离 |
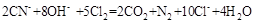 。下列判断错误的是
。下列判断错误的是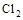
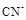 >
>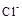
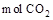 生成时,溶液中阴离子的物质的量增加1
生成时,溶液中阴离子的物质的量增加1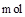
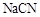 的水溶液呈碱性,说明
的水溶液呈碱性,说明