题目内容
1.现有X、Y、Z三种非金属元素,A、B、C三种金属元素,有如下情况:(1)X、Y、Z的单质在常温下均为气体.
(2)X的单质在Z的单质中燃烧,火焰呈苍白色.产物XZ的水溶液可使石蕊试液变红.
(3)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体.
(4)Z的单质溶于X2Y中所得溶液具有漂白性.
(5)A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈黄色溶液.
(6)B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解.
(7)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色固体M.
请完成下列问题:
①写出下列物质的化学式:XZHCl,X2YH2O.
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是HClO(填化学式)
③A的单质与Z的单质反应的化学方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
④BZ3与过量的NaOH溶液反应的离子方程式:Al3++4OH-═AlO2-+2H2O.
⑤X单质与Z单质的混合气体经点燃充分反应后,冷却至室温,再通入足量的NaOH溶液中,气体被完全吸收,求原混合气体中X单质与Z单质的体积比可能为V(氢气):V(氯气)≤1.
分析 X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ易溶于水,XZ的水溶液可使石蕊试液变红,说明X为H元素,Z为Cl元素,形成的单质为Cl2,形成的化合物为HCl;两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体,应为H2O,则Y为O元素;A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈棕黄色溶液,该棕红色固体为FeCl3,则A为Fe元素;B与Z形成的化合物BZ3溶于水加入NaOH溶液先生成白色沉淀后又逐渐溶解,该白色沉淀为Al(OH)3,BZ3为AlCl3,B为Al;C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色,该淡黄色固体为Na2O2,则C为Na,结合物质的性质解答该题.
解答 解:X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ易溶于水,XZ的水溶液可使石蕊试液变红,说明X为H元素,Z为Cl元素,形成的单质为Cl2,形成的化合物为HCl;两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体,应为H2O,则Y为O元素;A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈棕黄色溶液,该棕红色固体为FeCl3,则A为Fe元素;B与Z形成的化合物BZ3溶于水加入NaOH溶液先生成白色沉淀后又逐渐溶解,该白色沉淀为Al(OH)3,BZ3为AlCl3,B为Al;C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色,该淡黄色固体为Na2O2,则C为Na,
①由以上分析可知,XZ为HCl,X2Y为H2O,
故答案为:HCl、H2O;
②氯气溶于H2O中反应生成HCl和HClO,其中HClO具有漂白性,
故答案为:HClO;
③Fe在Cl2中燃烧生成,反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
④AlCl3与过量的NaOH溶液反应反应生成偏铝酸钠与水,反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
⑤氢气与氯气的混合气体经点燃:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,由于HCl、Cl2都能被NaOH溶液吸收,故V(氢气):V(氯气)≤1,
故答案为:V(氢气):V(氯气)≤1.
点评 本题考查无机物的推断,题目难度中等,本题主要根据物质反应的典型现象作为突破口,注意基础知识的积累.

| A. | 因为液态氨气化时吸热,可用液态氨作制冷剂 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 |

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是强碱腐蚀石英;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O(或3MnO42-+3CO2+2OH-═2MnO4-+MnO2↓+H2O+3CO32-);其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH.
提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).
图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
| A. | N2 | B. | NaOH | C. | H2O | D. | Ar |
| A. | KOH和NH4Cl | B. | SO2和SiO2 | C. | MgO和Na2O2 | D. | CCl4和KCl |
| A. | 收藏漆器工艺品应注意避免阳光暴晒 | |
| B. | “钻石恒久远,一颗永流传”中的钻石和漆器中的木炭均由碳元素组成 | |
| C. | 铜做胎骨的漆器,掉漆后长时间放置,铜的表面仍能保持光亮 | |
| D. | 漆的烷基部分碳原子数越多越难溶于水 |
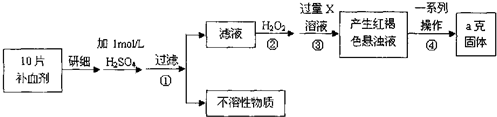
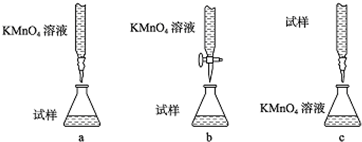
 (已知乙醇的键线式为
(已知乙醇的键线式为 )
)
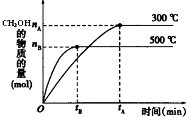 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.