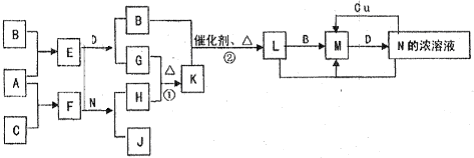
��Ŀ����
�ɶ�����Ԫ����ɵĻ�����X��ij����ҩ����Ч�ɷ֡���ͬѧ��̽��X����ɡ�
��������:
���ɶ�����Ԫ����ɵĿ���ҩ����Ч�ɷ���̼�����ơ�̼��þ����������������þ��������������ʽ̼��?þ��?��
��Al3+��pH=5.0ʱ������ȫ; Mg2+��pH=8.8ʱ��ʼ����,��pH=11.4ʱ������ȫ��
ʵ�����:
��.����X��ĩ�м����������,��������A,�õ���ɫ��Һ��
��.�ò�˿պȡ�����������õ���Һ,�ڻ���������,��ɫ���档
��.��������õ���Һ�еμӰ�ˮ,����pH��5 6,������ɫ����B,���ˡ�
��.�����B�мӹ���NaOH ��Һ,����ȫ���ܽ⡣
��.����еõ�����Һ�еμ�NaOH��Һ,����pH��12,�õ���ɫ����C��
(1)��������A ��ʹ����ʯ��ˮ�����,A�Ļ�ѧʽ��___________��?
(2)�ɢ��ж�Xһ�������е�Ԫ�����ס�___________ ��
(3)��������B�����ӷ���ʽ��____________��
(4)����B�ܽ�����ӷ���ʽ��_________��
(5)����C�Ļ�ѧʽ��_________��
(6)������n(A)��n(B)��n(C)=1��1��3����X�Ļ�ѧʽ��___________��
��������:
���ɶ�����Ԫ����ɵĿ���ҩ����Ч�ɷ���̼�����ơ�̼��þ����������������þ��������������ʽ̼��?þ��?��
��Al3+��pH=5.0ʱ������ȫ; Mg2+��pH=8.8ʱ��ʼ����,��pH=11.4ʱ������ȫ��
ʵ�����:
��.����X��ĩ�м����������,��������A,�õ���ɫ��Һ��
��.�ò�˿պȡ�����������õ���Һ,�ڻ���������,��ɫ���档
��.��������õ���Һ�еμӰ�ˮ,����pH��5 6,������ɫ����B,���ˡ�
��.�����B�мӹ���NaOH ��Һ,����ȫ���ܽ⡣
��.����еõ�����Һ�еμ�NaOH��Һ,����pH��12,�õ���ɫ����C��
(1)��������A ��ʹ����ʯ��ˮ�����,A�Ļ�ѧʽ��___________��?
(2)�ɢ��ж�Xһ�������е�Ԫ�����ס�___________ ��
(3)��������B�����ӷ���ʽ��____________��
(4)����B�ܽ�����ӷ���ʽ��_________��
(5)����C�Ļ�ѧʽ��_________��
(6)������n(A)��n(B)��n(C)=1��1��3����X�Ļ�ѧʽ��___________��
(1)CO2
(2)�ơ���
(3)
(4)
(5)
(6)
(2)�ơ���
(3)

(4)

(5)

(6)


��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ